
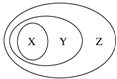
 如表所列物质或概念间的从属关系符合如图所示关系的是( )
如表所列物质或概念间的从属关系符合如图所示关系的是( )| 选项 | X | Y | Z |
| A | 光导纤维 | 酸性氧化物 | 传统无机非金属材料 |
| B | 纯碱 | 碱 | 化合物 |
| C | 氧化物 | 化合物 | 纯净物 |
| D | H2SO4 | 含氧酸 | 强酸 |
| A. | A | B. | B | C. | C | D. | D |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
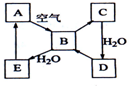 下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有HC1O存在 | |
| B. | 溶液呈黄绿色,且有刺激性气味,说明有C12分子存在 | |
| C. | 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有C1-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HC1O分子存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
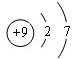 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 江河入海口三角洲的形成通常与胶体的性质有关 | |
| B. | 活泼金属元素的氧化物一定是碱性氧化物,非金属元素的氧化物一定是酸性氧化物 | |
| C. | H+、K+、S2-、Br-能在Fe(OH)3胶体中大量共存 | |
| D. | AgI胶体在电场中定向运动,是因为胶体是带电的 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 与水反应中既是氧化剂又是还原剂 | B. | 与NaOH反应生成溴化钠和次碘酸钠 | ||
| C. | 可作氧化剂 | D. | 与水反应是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验③说明KI被氧化 | |
| B. | 实验②中氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 实验①证明Cl-具有还原性 | |
| D. | 上述实证明氧化性:ClO3->Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com