
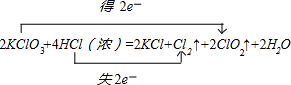 ,故答案为:
,故答案为: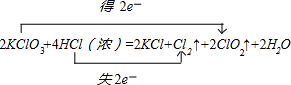 ;
;

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
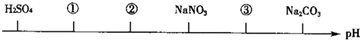
| A、NH4Cl;(NH4)2SO4;CH3COONa |
| B、(NH4)2SO4;NH4Cl;CH3COONa |
| C、(NH4)2SO4;NH4Cl;NaOH |
| D、CH3COOH;NH4Cl;(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
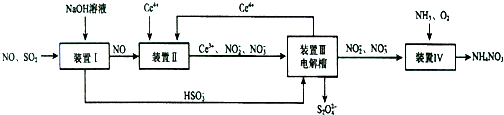
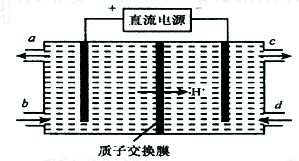
查看答案和解析>>
科目:高中化学 来源: 题型:
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的( )| A、此有机物含有如下的官能团:含有碳碳双键、羟基、羰基、羧基 |
| B、1mol该有机物与NaOH 溶液反应,耗2mol.与氢气反应耗氢气5mol |
| C、该有机分子中没有一个有手性碳 |
| D、该有机物不存在顺反异构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应是放热反应 |
| B、该反应是吸热反应 |
| C、该反应中反应物总能量小于生成物总能量 |
| D、无法确定该反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
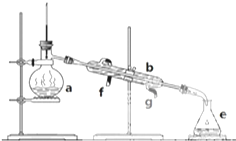 掌握仪器名称、组装及使用方法是中学化学实验的基础,图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,图为实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com