
下列说法正确的是( )
A.同温同压下 甲烷和氧气的密度之比为2
甲烷和氧气的密度之比为2 ∶1
∶1
B.1 g甲烷和1 g氧气的原子数之比为5∶1
C.等物质的量的甲烷和氧气的质量之比为2∶1
D.在标准状况下等质量的甲烷和氧气的体积之比为1∶2
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
PCl3和PCl5都是重要的化工原料。将PCl3(g) 和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl2(g) PCl5(g)有关数据如下:
PCl5(g)有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
下列判断不正确的是
A.10 min内,v(Cl2) = 0.04 mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.升高温度(T1<T2),若反应的平衡常数减小,则平衡时PCl3的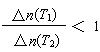
D.平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高二上9月月考化学试卷(解析版) 题型:填空题
某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
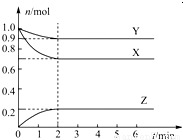
(1)该反应的化学方程式为________________________;
(2)反应开始至2min,用气体Z表示的反应速率为_____________;
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的__________倍;
②若此时将容器的体积缩小为原来的0.5倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为__________反应(填“放热”或“吸热”).
(4)若上述反应在2min后的t1~t6内反应速率与反应时间图象如下,
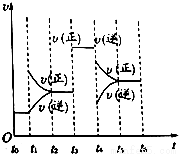
在每一时刻均改变一个影响反应速率的因素,则①t1、t3、t4时刻体系中分别改变的是什么条件?
t1:______________,t3:_______________,t4:_____________.
②下列各时间段时,Z的体积分数最高的是___________
A.t2~t3 B.t3~t4 C.t4~t5 D.t5~t6.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高二上9月月考化学试卷(解析版) 题型:选择题
某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示.下列说法正确的是( )
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数K=6.75
B.若升高温度,W的体积分数减小,则此反应△H>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是 K= 
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高一上学期期中化学卷(解析版) 题型:填空题
(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为__________mol/L。
(2)若从中取出50 mL,其物质的量浓度为___________mol/L;溶质的质量为_________g。
(3)若将这50 mL溶液用水稀释到100 mL,所得稀溶液中Na+的物质的量浓度为_________mol/L,SO42-的物质的量浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高一上学期期中化学卷(解析版) 题型:选择题
常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是( )

查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高一上学期期中化学卷(解析版) 题型:选择题
当光束通过下列分散系:①有尘埃的空气、②稀硫酸、③蒸馏水、 ④墨水,能观察到丁达尔效应的是
A.①② B.②③ C.①④ D.②④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上学期期中化学卷(解析版) 题型:选择题
在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+ 3H2(g)
 CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
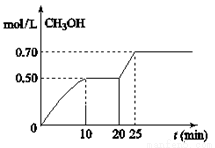
A.从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min)
B. 从20分钟到25分钟达到新的平衡,可能是增大压强
从20分钟到25分钟达到新的平衡,可能是增大压强
C.其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小
D.从开始到25分钟,CO2的转化率是70%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上月考一化学试卷(解析版) 题型:填空题
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+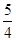 O2(g)=
O2(g)=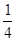 P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。

则反应P4(s,白磷)+6Cl2(g)==4PCl3(s)的反应热ΔH= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com