
| A. | A>B>C>D | B. | C>D>A>B | C. | D>A>B>C | D. | A>B>D>C |
分析 原电池中被腐蚀的金属是活动性强的金属;金属和相同的酸反应时,活动性强的金属反应剧烈;金属的置换反应中,较活泼金属能置换出较不活泼的金属.
解答 解:两种活动性不同的金属和电解质溶液构成原电池,较活泼的金属作负极,负极上金属失电子发生氧化反应被腐蚀,较不活泼的金属作正极,
①将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,所以A的活动性大于B.
②金属和相同的酸反应时,活动性强的金属反应剧烈,将A、D分别投入等浓度盐酸溶液中,D比A反应剧烈,所以D的活动性大于A;
③金属的置换反应中,较活泼金属能置换出较不活泼的金属,将铜浸入B的盐溶液中,无明显变化,说明B的活动性大于铜.如果把铜浸入C的盐溶液中,有金属C析出,说明铜的活动性大于C.
所以金属的活动性顺序为:D>A>B>C,
故选C.
点评 本题考查了金属活动性强弱的判断,难度不大,能从原电池的负极、金属之间的置换反应、金属与酸或水反应的剧烈程度、金属氧化物的水化物的碱性强弱等方面来判断金属的活动性强弱.


科目:高中化学 来源: 题型:选择题
| A. | c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42- ) | B. | c(HC2O4-)+c(C2O42-)=0.01 mol•L-1 | ||
| C. | c(C2O42- )<c(H2C2O4) | D. | c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y、Z、W形成的离子具有相同电子层结构,离子半径依次增大 | |
| B. | 39g Z2Y2中含有的离子数约为1.204×1024 | |
| C. | Y的最高正价为+6 | |
| D. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃分子中,所有的化学键都是单键 | |
| B. | 烷烃在光照条件下都能与氯气发生取代反应 | |
| C. | 烷烃的分子通式为CnH2n+2,符合通式的烃不一定是烷烃 | |
| D. | 随着碳原子数的增加,烷烃的熔沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阴极没有气体生成 | |
| B. | 电解过程中转移的电子的物质的量为0.4 mol | |
| C. | 原CuSO4溶液的浓度为0.1 mol•L-1 | |
| D. | 电解过程中阳极收集到的气体体积为2.24 L(标况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
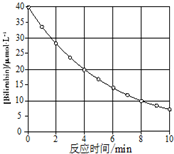 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8min间的平均反应速率和推测第16min反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8min间的平均反应速率和推测第16min反应物的浓度,结果应是( )| A. | 2.5 μmol•L-1•min-1 和2.0 μmol•L-1•min-1 | |
| B. | 2.5 μmol•L-1•min-1 和2.5 μmol•L-1•min-1 | |
| C. | 3.0 μmol•L-1•min-1 和3.0 μmol•L-1•min-1 | |
| D. | 5.0 μmol•L-1•min-1 和3.0 μmol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体颜色不再变化 | B. | 混合气体密度不再变化 | ||
| C. | 2v正(N2O4)=v逆(NO2) | D. | 混合气体相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com