
【题目】氯化铁是一种常见的水处理剂,无水氯化铁遇潮湿空气,极易吸水生成![]() 。在实验室中,可以采用下列仪器和药品制取较纯的无水氯化铁固体。
。在实验室中,可以采用下列仪器和药品制取较纯的无水氯化铁固体。

(1)实验开始时,先点燃______处的酒精灯![]() 填A或
填A或![]() 。A中发生反应的化学方程式为______。
。A中发生反应的化学方程式为______。
(2)![]() 装置中盛放的是饱和食盐水,其作用为______。
装置中盛放的是饱和食盐水,其作用为______。
(3)![]() 装置中的试剂为浓硫酸,其作用是______。用一件仪器装填适当试剂后,也可起到F和G的作用,所装填的试剂为______。
装置中的试剂为浓硫酸,其作用是______。用一件仪器装填适当试剂后,也可起到F和G的作用,所装填的试剂为______。
【答案】A ![]() 吸收氯气中的HCl 防止F中水蒸气进入E中 碱石灰
吸收氯气中的HCl 防止F中水蒸气进入E中 碱石灰
【解析】
(1)为排尽装置中的氧气,实验开始时,先点燃A处的酒精灯,反应生成的氯气充满D装置后再加热D处的酒精灯,A中反应为二氧化锰与浓盐酸反应生成氯气;
(2)为减少氯气的溶解性,常用饱和食盐水除去氯气中的HCl气体;
(3)F和G装置作用为吸收未反应完的氯气和防止水蒸气进入E中,可碱性干燥剂代替。
(1)利用软锰矿与浓盐酸制取![]() ,需要加热装置,首先点燃装置A的酒精灯制取
,需要加热装置,首先点燃装置A的酒精灯制取![]() ,
,![]() 与浓盐酸反应产生
与浓盐酸反应产生![]() 、
、![]() ,所以反应方程式为:
,所以反应方程式为:![]() ,故答案为:A;
,故答案为:A;![]() ;
;
(2)![]() 装置中盛放的是饱和食盐水,反应产生的
装置中盛放的是饱和食盐水,反应产生的![]() 中混有部分HCl,混合气体通过饱和食盐水HCl被吸收,
中混有部分HCl,混合气体通过饱和食盐水HCl被吸收,![]() 的溶解度不大,所以作用为:吸收氯气中的HCl,故答案为:吸收氯气中的HCl;
的溶解度不大,所以作用为:吸收氯气中的HCl,故答案为:吸收氯气中的HCl;
(3)F装置中的试剂为浓硫酸,浓硫酸具有吸水性,防止水蒸气进入装置E中,用一件仪器装填适当试剂后,也可起到F和G的作用,F吸水,G处理产生的尾气,G为碱性,所以可用碱石灰代替,故答案为:防止F中水蒸气进入E中;碱石灰。


科目:高中化学 来源: 题型:
【题目】以下是合成聚对苯二甲酸—1,4—丁二醇酯的合成路线图:

(1)实验室制备乙炔的方程式为______。
(2)化合物A的结构简式为______。
(3)③的反应类型为______。
(4)写出反应⑥的化学方程式______。
(5)D有多种同分异构体,符合以下条件的共有______种,写出其中一种同分异构体的结构简式______。
①能发生水解反应,遇饱和FeCl3溶液显色;
②1mol该同分异构体能与足量银氨溶液生成4mol Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命法写出下列物质名称或结构简式
(1)C4H10的一氯代物有_____________种。
(2)某有机物含C、H、O三种元素,分子模型如图所示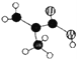 (图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_______,所含官能团的名称为 __________。
(图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_______,所含官能团的名称为 __________。
(3)常温下,已知0.1 mol·L-1一元酸HA溶液中![]() =1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=________;写出该酸(HA)与NaOH溶液反应的离子方程式: _______________________________。
=1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=________;写出该酸(HA)与NaOH溶液反应的离子方程式: _______________________________。
(4)25℃时,已知Ksp[Fe(OH)3]=8×10-38,则0.01mol/L FeCl3溶液中欲使Fe3+沉淀,求溶液所需的最小pH=________。(用对数形式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用pH计测量VmL0.1mol·L-1NaOH溶液中逐滴滴加等浓度的一元酸HA后pH的变化情况,绘制pH变化曲线如图所示,下列说法不正确的是( )

A. A点溶液的pH=13
B. B和C两点所示溶液中水的电离程度:B>C
C. pH=7时,溶液中存在:c(Na+)=c(H+)+(HA)
D. C点所示溶液中离子浓度大小顺序:c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
①增加少量![]() ②升高温度③体积不变,再通入
②升高温度③体积不变,再通入![]() ④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质中含有C、H、O、N、S等元素,食物中的铁主要以三价铁与蛋白质和羧酸结合成络合物的形式存在。
(1)在蛋白质中涉及的碳、氮、氧元素第一电离能由小到大的顺序是________________;基态铁原子的价电子排布式为____________。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为________(填化学式)。1 mol CN-中含有的π键的数目为____________________。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(其分子式为Fe2Cl6)存在的结构式为________________,其中Fe的配位数为____________。
(4)金属化合物Cu2Zn合金能导电,熔点较高,强度、硬度较大。Cu2Zn合金的晶体类型是_______。
(5)某含铜化合物的离子结构如图所示。
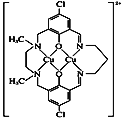
①该离子中存在的作用力有_______________;
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
②该离子中N原子的杂化类型有________。
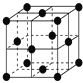
(6)铜晶体为面心立方最密堆积,即在晶体结构中可以分割出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个面上,已知铜的原子半径为127.8 pm,列式计算晶体铜的密度:ρ=______________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:

已知相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH如下:
金属离子 | Fe3+ | Mn2+ | Al3+ |
开始沉淀的pH | 2.7 | 8.3 | 3.2 |
沉淀完全的pH | 3.7 | 9.8 | 5.0 |
回答下列问题:
(1)MnO2本身不能溶于硫酸,但是在Fe2+的作用下却能溶解,写出该反应的离子方程式:____________________________。
(2)滤渣1的成分除了SiO2外,还有一种淡黄色的物质是_______________(填化学式)。
(3)除杂步骤中加入的MnCO3的作用是____________________________,该过程需调节溶液pH的范围是___________________________,若把pH调得过高,其后果是_________________________。
(4)用惰性电极进行电解,电解刚开始时阴极的电极反应式为____________________,电解后阳极的电解质溶液可返回_______________________(填“酸浸”“除杂”或“电解”)工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数值,下列说法正确的是
表示阿伏加德罗常数值,下列说法正确的是
A.![]() 时,
时,![]() 的
的![]() 的NaClO溶液中水电离出的
的NaClO溶液中水电离出的![]() 的数目为
的数目为![]()
B.标准状况下,![]() 甲醇中含有的氧原子数为
甲醇中含有的氧原子数为![]()
C.标准状况下,![]() 氯气与足量NaOH溶液反应转移的电子数为
氯气与足量NaOH溶液反应转移的电子数为![]()
D.同温同压下,原子数均为![]() 的氢气和氦气具有相同的体积
的氢气和氦气具有相同的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液存在H2CO3/HCO3-、HPO42-/H2PO4-等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lg x[x表示c(H2CO3)/c(HCO3-)或c(HPO42-)/c(H2PO4-)]与pH的关系如图所示。已知碳酸pKal=6.4、磷酸pKa2=7.2(pKa= -lgKa)。则下列说法正确的是
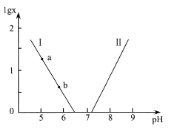
A. 曲线I表示lg c(HPO42-)/c(H2PO4-)与pH的变化关系
B. a-b的过程中,水的电离程度逐渐减小
C. 当c(H2CO3)=c(HCO3-)时,c(HPO42-)=c(H2PO4-)
D. 当pH增大时,c(HCO3-)c(H2PO4-)/c(HPO42-)逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com