(2008?淮南一模)(1)某校学生为探究乙二酸(俗称草酸)的部分化学性质,进行了下述实验:
Ⅰ、向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的高锰酸钾稀溶液,振荡,观察到的现象为
溶液的紫红色褪去
溶液的紫红色褪去
,说明乙二酸具有
还原性
还原性
(填“氧化性”、“还原性”或“酸 性”).
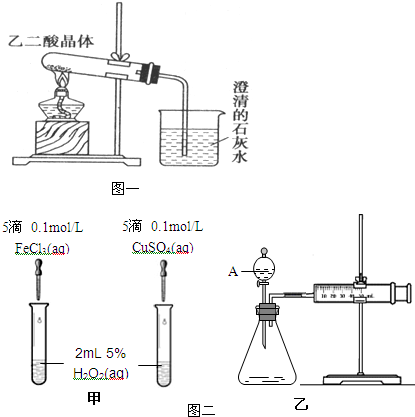
Ⅱ、课本实验设计得简要明了,但也存在一些不足,在探究过程中对其进行分析与改进也是研究性学习的一个重要课题.已知草酸晶体(H
2C
2O
4?2H
2O)受热易分解(分解温度为175℃)产生CO和CO
2,图一为高三课本中关于草酸晶体受热分解及验证其部分分解产物的实验装置图.
1)写出草酸晶体受热分解的化学方程式
.
2)设计该装置欲验证的分解产物是
CO2
CO2
.
3)草酸晶体的某些物理性质如下表:
|
分子式 |
颜色、状态 |
水溶性 |
熔点/℃ |
密度/g.cm-3 |
| 草酸晶体 |
H2C2O4?2H2O |
无色晶体 |
易溶于水 |
101.5 |
1.650 |
有的同学认为,用该装置进行实验,存在着不合理因素,请分析指出(任答两点):
①
草酸晶体在未达到分解温度之前,已融化成液体流出,使实验难以进行
草酸晶体在未达到分解温度之前,已融化成液体流出,使实验难以进行
.
②
该装置没有尾气处理,CO会污染空气
该装置没有尾气处理,CO会污染空气
.
(2)为比较Fe
3+和Cu
2+对H
2O
2分解的催化效果,某化学研究小组的同学分别设计了如图二中甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察
反应产生气泡快慢或反应完成的先后或试管壁的冷热程度
反应产生气泡快慢或反应完成的先后或试管壁的冷热程度
,定性比较得出结论.有同学提出将FeCl
3改为Fe
2(SO
4)
3 更为合理,其理由是
控制阴离子相同,排除阴离子的干扰
控制阴离子相同,排除阴离子的干扰
,写出H
2O
2在二氧化锰作用下发生反应的化学方程式
.
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.图中仪器A的名称为
分液漏斗
分液漏斗
,检查该装置气密性的方法是
关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;或固定注射器活塞,打开A处活塞,往分液漏斗中加水一段时间后液体不再流下证明该装置不漏气
关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;或固定注射器活塞,打开A处活塞,往分液漏斗中加水一段时间后液体不再流下证明该装置不漏气
,实验中需要测量的数据是
收集一定体积的气体所需要的时间
收集一定体积的气体所需要的时间
.




 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案