
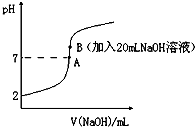
 氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF═H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF═H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.分析 (1)HF酸中存在HF?F-+H+,为使电离常数或电离度增大,应使平衡正向移动;
(2)由图象可知0.2mol•L-1的氢氟酸的pH=2,则c(H+)=0.01mol/L,以此可计算电离度和电离常数;
(3)根据物料守恒、质子守恒以及影响盐类水解的角度可解答该题;
(4)根据平衡常数和浓度熵之间的关系来计算回答.
解答 解:(1)HF酸中存在HF?F-+H+,为使电离度增大,应使平衡正向移动,
a.升高温度,可使平衡正向移动,电离常数或电离度增大,故a正确;
b.向溶液中滴入2滴浓盐酸以及c.加入少量NaF固体,都可使平衡逆向移动,电离度减小,故b、c错误,
d、加水稀释会促使电离平衡正向移动,使电离度增大,故d正确;所以ad能使电离度增大,但是K只是温度的函数,电离是吸热的,温度升高,K增大.
故答案为:ad;a;
(2)由图象可知0.2mol•L-1的氢氟酸的pH=2,则c(H+)=0.01mol/L,可知电离的c(HF)=0.01mol/L,
则α=$\frac{0.01mol/L}{0.2mol/L}$=5%,
K=$\frac{[{H}^{+}]•[{F}^{-}]}{[HF]}$=$\frac{0.01×0.01}{0.2-0.01}$≈5×10-4,
故答案为:5×10-4; 5;
(3)a.在A处溶液中,由于加入NaOH溶液,则总体积大于20mL,则c(F-)+c(HF)<0.2mol•L-1,故a错误;
b.在B处溶液中,HF和NaOH完全反应生成NaF,由质子守恒可知:c(H+)+c(HF)=c(OH-),故b正确;
c.在B处溶液pH>7,则c(H+)<c(OH-),故c错误;
d.由于温度不变,则电离常数不变,则在A和B处溶液中都符合:$\frac{[{H}^{+}]•[{F}^{-}]}{[HF]}$═Ka(HF),故d正确;
故答案为:bd;
(4)混合后c(F-)=10-2mol/L,c(Ca2+)=9×10-5mol/L,Qc=9×10-9>Ksp有沉淀产生,
故答案为:混合后c(F-)=10-2mol/L,c(Ca2+)=9×10-5mol/L,Qc=9×10-9>Ksp有沉淀产生.
点评 本题考查弱电解质的电离平衡的影响因素以及电离平衡常数的有关计算等知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握影响盐类水解和弱电解质电离的因素,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 探究温度对反应速率影响时,应先分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度后再混合,不是先将两种溶液混合后再用水浴加热 | |
| B. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| C. | 使用含有氯化钠的融雪剂会加快铁桥梁的腐蚀 | |
| D. | 判断皂化反应是否完全,可取反应后的混合液滴入热水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与12C60的碳原子化学性质不同 | B. | 与15N含的中子数相同 | ||
| C. | 与12C60互为同素异形体 | D. | 与12C、13C互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玉米芯、甘蔗渣等在稀硫酸作用下水解所得的木糖C5H10O5,属于多羟基醛,木糖与浓硫酸加热作用可生成糠醛 ,由木糖生成糠醛的反应有消去反应 ,由木糖生成糠醛的反应有消去反应 | |
| B. | 醛类、葡萄糖、甲酸及其甲酸酯类均能发生银镜反应 | |
| C. | 阿斯巴甜是目前使用最广泛的甜味剂,其结构简式为 它既能与酸反应又能与碱反应,是一种常见的氨基酸 它既能与酸反应又能与碱反应,是一种常见的氨基酸 | |
| D. | BAD是一种紫外线吸收剂,它的结构简式如下: 1 mol BAD最多能和含6 mol NaOH的溶液进行反应 1 mol BAD最多能和含6 mol NaOH的溶液进行反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与二氧化碳反应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 钢铁制品生锈的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.| 较大量存在的含金属元素的离子 | 检验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:A(g)+3B(g)?M(g)+N(g);△H=-49.0kJ•mol-1.一定条件下,向体积为2L的密闭容器中充入2mol A和6molB,测得A和M的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:A(g)+3B(g)?M(g)+N(g);△H=-49.0kJ•mol-1.一定条件下,向体积为2L的密闭容器中充入2mol A和6molB,测得A和M的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )| A. | 充分反应后该反应放出98 kJ的热量 | |
| B. | 10min后,升高温度能使$\frac{n(M)}{n(A)}$增大 | |
| C. | 3min时B的生成速率是M生成速率的3倍 | |
| D. | 反应到达平衡时刻B的转化率为75% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com