
(10分)工业制硫酸生产流程如下图:
|

(1)造气阶段,为提高反应的效率,充分利用含硫矿石,请你提出两条可行的措施:
、
|
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ·mol-1
2SO3(g) ΔH=-196 kJ·mol-1
 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,SO2的浓度是原平衡时的60%,则
达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,SO2的浓度是原平衡时的60%,则
A.平衡向逆反应方向移动了
B.SO2的转化率减小了
C.SO3的质量分数增加了
D.平衡移动过程中,v(逆)< v(正)
(3)在催化反应室,发生(2)中的反应,已知:某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回答:
①将1.0mol SO2和0.05mol O2置于10L密闭容器中,反应达平衡后,若体系总压强为0.10 MPa。该反应的平衡常数等于 。
②平衡状态由A变到B时,平衡常数K(A) K(B) (填“>”、“<”或“=”)。
(4)增大体系的压强能使(2)中平衡向正反应方向移动,但在实际生产中采用了常压的条件,你认为可能的原因是: 。
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:贵州省云峰中学2010届高三下学期3月月考化学试题 题型:022
工业制硫酸生产流程如下图:

(1)早期生产用黄铁矿为原料,但现在工厂生产硫酸用硫磺为原料,理由是________________.
(2)在催化反应室,使用常压的原因是:________________.
(3)在气体进入催化反应室前,需净化的原因是:_____________.
(4)已知2SO2(g)+O2(g)![]() 2SO3(g),ΔH=-196 kJ·mol-1.在450℃、常压和钒催化条件下向一密闭容器中充入2 mol SO2和1 mol O2,充分反应后,放出的热量________(填“<”“>”“=”)196 kJ.
2SO3(g),ΔH=-196 kJ·mol-1.在450℃、常压和钒催化条件下向一密闭容器中充入2 mol SO2和1 mol O2,充分反应后,放出的热量________(填“<”“>”“=”)196 kJ.
(5)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%.在500℃,0.1 MPa条件下达到平衡时,各种气体的体积比为V(SO2)∶V(SO3)∶V(O2)∶V(N2)=0.46∶6.54∶7.73∶82,则SO2的利用率为________.
(6)在450℃、常压和钒催化条件下,在容积为VL的容器中加入2n mol SO2和n mol O2,反应达平衡后测得平衡常数为K,此时O2的转化率为x.则K和x的关系满足K=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制硫酸生产流程如下图:

(1)早期生产用黄铁矿为原料,但现在工厂生产硫酸用硫磺为原料,理由是
(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.减少压强
C.不断补充SO2和空气 D.及时分离出SO3
(3)在生产中,为提高催化剂效率采取了哪些措施?
(4)已知2SO2(g)+O2(g)![]() 2SO3(g),ΔH=-196 kJ?mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是________________________________________。
2SO3(g),ΔH=-196 kJ?mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是________________________________________。
(5)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下达到平衡时,各种气体的体积比为V(SO2):V(SO3):V(O2):V(N2)=0.46:6.5:7.7:82,则SO2的利用率为
(6)在450℃、常压和钒催化条件下,在容积为VL的容器中加入2n molSO2和n molO2,反应达平衡后测得平衡常数为K,此时O2的转化率为x。则K和x的关系满足K= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)工业制硫酸生产流程如下图:

(1)在气体进入催化反应室前,需净化的原因是:________________________________。
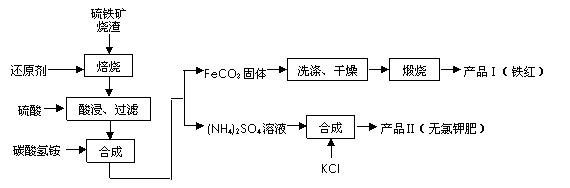
(2)在制气过程中,我国往往以黄铁矿为原料制SO2 ,其铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
已知几种盐的溶解度随温度变化的曲线如下图所示:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
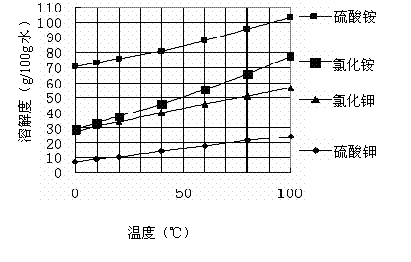
则:
①酸浸、过滤后滤液中的金属阳离子是________________。
②煅烧FeCO3生成产品Ⅰ的化学反应方程式为_______________________________ _。
③产品Ⅱ的化学式为_______________
④检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
查看答案和解析>>
科目:高中化学 来源: 题型:
(08茂名市二模)(15分)工业制硫酸生产流程如下图:

(1)早期生产用黄铁矿为原料,但现在工厂生产硫酸用硫磺为原料,理由是 (2分
(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 (2分)
A.升高温度 B.减少压强
C.不断补充SO2和空气 D.及时分离出SO3
(3)在生产中,为提高催化剂效率采取了哪些措施?
(3分)
(4)已知2SO2(g)+O2(g)![]() 2SO3(g),ΔH=-196 kJ?mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________。 (3分)
2SO3(g),ΔH=-196 kJ?mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是______________________________________________。 (3分)
(5)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下达到平衡时,各种气体的体积比为V(SO2):V(SO3):V(O2):V(N2)=0.46:6.5:7.7:82,则SO2的利用率为 (3分)
(6)在450℃、常压和钒催化条件下,在容积为VL的容器中加入2n molSO2和n molO2,反应达平衡后测得平衡常数为K,此时O2的转化率为x。则K和x的关系满足K= 。(2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com