
| A. | +5,7 | B. | +5,5 | C. | +7,7 | D. | +6,6 |
分析 根据离子方程式判断n值,进而根据化合价代数和为0计算R的化合价,根据R的最高化合价判断其在周期表中的位置.
解答 解:在反应RO3n-+6I-+6H+=R-+3I2+3H2O中,从离子方程式电荷守恒的角度可知,n=1,则在中RO3-,R的化合价为+5价,
RO3n-中R元素的化合价不一定为最高正价,应根据反应物中R-离子的化合价进行判断,根据生成R-离子可知R得1个电子后达到8电子稳定结构,最外层电子数为7,应为第ⅦA族元素;故A正确.
故选:A.
点评 本题考查根据化学式判断化合价,注意离子方程式电荷守恒以及离子化合价的判断等问题,题目难度不大,做题时注意“RO3n-中R元素的化合价不一定为最高正价”.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
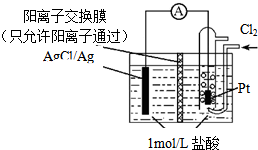
| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 用KCl溶液代替盐酸,则电池总反应不改变 | |
| D. | 当电路中转移0.1mol e-时,通过交换膜的阳离子为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
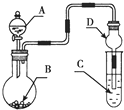
| A. | 若A为浓盐酸,B为KMnO4晶体,C是紫色石蕊溶液,则C中溶液最终呈红色 | |
| B. | 若A为浓硫酸,B为Na2SO3固体,C中是NaOH溶液,实验仪器D可以起到防止溶液倒吸的作用 | |
| C. | 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解 | |
| D. | 若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “水滴石穿”说明水在重力的作用下穿透石块,只涉及物理变化 | |
| B. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| C. | “甘之如饴”说明糖类均有甜味 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
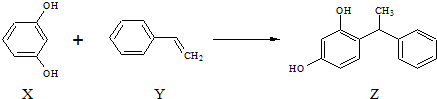
| A. | X、Z均能与Na2CO3溶液反应 | |
| B. | X可作缩聚反应单体,Y可作加聚反应单体 | |
| C. | X、Y、Z 均能使溴水褪色,但是原理不完全相同 | |
| D. | 该反应的反应类型为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
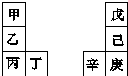 甲~辛等元素在周期表中的相对位置如表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素.下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素.下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>戊>己 | |
| C. | 丙与庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 | |
| B. | NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 | |
| D. | 甲烷中心原子的价电子全部成键且成键的对象相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com