
【题目】如图所示,是在其他条件一定时,反应2A+B2C△H<0,A的最大转化率与温度关系曲线,下列叙述正确的是( ) 
A.X或Y两点相应,V(正)>V(逆)
B.Z、N两点表示未达平衡状态,且都是V(正)>V(逆)
C.W点表示非平衡状态,V(正)>V(逆)
D.相应反应速率大小的点:W>Y>N
【答案】B
【解析】解:根据图片知,曲线表示不同温度下A的物质达到平衡时曲线,在该曲线上的X、Y点都是平衡状态,Z、W、N点都是非平衡状态,平衡状态时V(正)=V(逆), A.X或Y两点都是平衡点,所以V(正)=V(逆),故A错误;
B.Z、N两点表示未达平衡状态,要使反应达到平衡状态,反应应该向正反应方向元素,所以这两点都是V(正)>V(逆),故B正确;
C.W点表示非平衡状态,要使该反应达到平衡状态,则应该减小A的转化率,平衡向逆反应方向移动,所以V(正)<V(逆),故C错误;
D.对于有气体参加或生成的可逆反应,压强越大反应速率越大,W、Y、N三点的压强大小顺序是N>Y>W,所以相应反应速率大小的点:W<Y<N,故D错误;
故选B.
根据图片知,曲线表示不同温度下A的物质达到平衡时曲线,在该曲线上的X、Y点都是平衡状态,Z、W点都是非平衡状态,平衡状态时V(正)=V(逆),对于有气体参加或生成的可逆反应,压强越大反应速率越大,据此分析解答.


科目:高中化学 来源: 题型:
【题目】化学反应速率是化学反应原理的重要组成部分.请回答下列问题:
(1)已知一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)△H<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件). 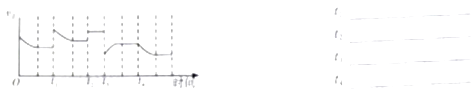
(2)探究反应条件对0.l0mol/L,Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如表:
编号 | 反应温度/℃ | Na2S2O3浓液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
① | 25℃ | 10.0 | 0 | 10.0 | |
② | 25℃ | 5.0 | a | 10.0 | |
③ | 45℃ | 10.0 | 0 | 10.0 |
上述实验①③是探究对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为 , a为;乙是实验需要测量的物理量,则表格中“乙”为 .
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大. ①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入(填字母序号).
A.硫酸钾B.氯化锰c.硫酸锰D.水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.共价化合物中可能含有离子键
B.Ca2+、K+、Cl﹣、S2﹣四种粒子的离子半径依次减小
C.![]() Po、
Po、 ![]() Po、
Po、 ![]() Po三种原子的核外电子数分别为124、125、126
Po三种原子的核外电子数分别为124、125、126
D.第ⅥA族元素氧、硫、硒对应的氢化物H2O、H2S、H2Se的稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成有关问题。
【实验药品】:
12.6g镁铝合金,200ml a mol/L稀硫酸,520ml 4 mol/L NaOH溶液。
【实验步骤】:
①将12.6g镁铝合金与200mL a mol/L的稀硫酸在如图所示装置中充分反应至反应完毕,并收集生成的全部气体。
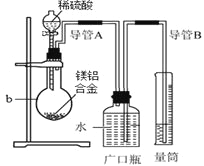
②向b内的混合液中逐滴加入520ml 4 mol/L氢氧化钠溶液并充分混合,当氢氧化钠溶液加至500mL时生成的沉淀量最大。
【问题讨论】:
(1)仪器b的名称是___________________。
(2)根据实验目的可知,12.6g镁铝合金与200mL a mol/L的稀硫酸反应时,应该过量的物质是____________(填“镁铝合金”或“稀硫酸”),以保证另一种物质能够完全反应无剩余;若标准状况下,由实验步骤①得到的气体为13.44L,则合金中镁的质量分数为__________________________(保留到0.1%)。
(3)实验步骤②中,当b内混合液中因滴加氢氧化钠溶液至生成的沉淀量最大时,此时所得溶液中的溶质是__________________(填化学式)。
(4)实验步骤①结束后,读取量筒所呈现的数据时,需要注意的三个问题是:一是要冷却到室温,二是要_____________________________,三是要视线与量筒内的凹液面相平。
(5)在“a mol/L稀硫酸”中的a的值为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第周期,第族;
(2)X可形成双原子分子,其分子的电子式是;Y和氢元素形成的10电子微粒中常见的+1价阳离子为(填化学式,下同);Z和氢元素形成的18电子微粒中常见的﹣1价阴离子为;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2 , 该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:
(1)R基态原子的电子排布式是 , X和Y中电负性较大的是(填元素符号).
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 .
(3)X与M形成的XM3分子的空间构型是 .
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是(填离子符号).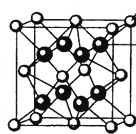
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,①5gH2 ②11.2LO2 ③2molH2O ④6.02×1023个 CO2分子。
(1)5gH2 的物质的量是__________,体积是__________;
(2)6.02×1023个 CO2分子的物质的量是__________,质量是__________,
(3)所含分子数最多的是_________(请用序号回答,后同);
(4)所含原子数最多的是_________;
(5)质量最大的是_________;
(6)体积最大的是_________;
(7)气体密度最大的是_________;
(8)体积最小的是_________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com