
(12分)重铬酸钠Na2Cr2O7·2H2O俗称红矾钠,是一种重要的无机盐产品,可作氧化剂,在印染、颜料、电镀、医药等工业方面有广泛的用途。某化学兴趣小组设计实验测定市场上的红矾钠中Na2Cr2O7的质量分数,其步骤如下:
I.称取Wg红矾钠,溶于酸配成l00mL溶液;
Ⅱ.用cmol·L-1的标准KMnO4酸性溶液滴定20.00mL一定浓度的FeSO4溶液,消耗KMnO4溶液20.00rnL;
Ⅲ.取20.00mL Na2Cr2O7溶液,用上述FeSO4溶液滴定,达到滴定终点时,消耗24.00mLFeSO4溶液;
查阅资料知:Cr相对原子质量为52
Cr2O2-7具有强氧化性,在酸性条件下易被还原为Cr3+
回答下列问题:
(1)Na2Cr2O7与FeSO4的反应离子方程式为 .
(2)步骤Ⅱ中的滴定过程选用 (填“酸式”或“碱式”)滴定管。
(3)已知:MnO-4+5Fe2++8H+==Mn2++5Fe3++4H2O,此红矾钠中Na2Cr2O7的质量分数的表达式为 。
(4)判断下列操作对Na2Cr2O7的质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”):
①步骤Ⅲ中的滴定过程,滴定终点读数时俯视读数 ;
②配制c mol·L-1的KMnO4标准溶液时,转移时有少量溶液洒出 。
(5)有同学提出FeSO4有很强的还原性,在空气中易被氧化而变质,因此对测定结果会造成影响,请你分析后指出,如果FeSO4变质,对测定结果的影响是 (填“偏高”、“偏低”或“无影响”)。
科目:高中化学 来源: 题型:
| ||
| A、反应①和②均为氧化还原反应 |
| B、反应①的氧化剂是O2,还原剂是FeO?Cr2O3 |
| C、高温下,O2的氧化性大于Fe3O3小于NaCrO4. |
| D、生成1mol的Na2Cr2O7时整个反应过程共转移6mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等。以铬铁矿(主要成分为Cr2O3还含有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下:
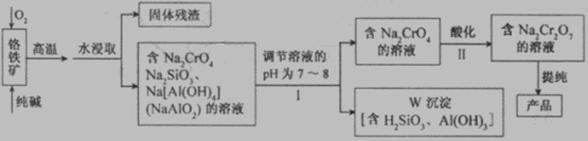 请回答下列问题。
请回答下列问题。
(1)若I中只用一种试剂调节溶液的pH,应选用___________(填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
(2)I中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是
_______________________________________________________ (用离子方程式表示)。
(3)Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下: 2CrO42- (黄色)+2H+![]() Cr2O72- (橙红色)+H2O
Cr2O72- (橙红色)+H2O
①该反应________氧化还原反应(填“是”或“不是”),反应的平衡常数表达式 K=__________。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液_______ (填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃时,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
交警常用“司机饮酒检测仪”检查司机是否酒后驾车,其原理是硫酸酸化的重铬酸盐(Cr2O72-橙红色)和乙醇反应生成铬盐(Cr3+绿色)和乙酸等。重铬酸钠(Na2Cr2O7)在工业中有很广泛的应用,常用来制备金属铬。方法如下:
将铬铁矿[主要成分Fe(CrO2)2]与纯碱、氧气高温焙烧,除杂、酸化,得到重铬酸钠,碳和重铬酸钠在高温下反应生成Cr2O3、Na2CO3和CO,Cr2O3再经铝热法还原,即可制得金属铬。请回答:
(1)硫酸酸化的K2Cr2O7和乙醇反应的化学方程式是 。
(2)写出碳和重铬酸钠高温反应的化学方程式 。
Cr2O3经铝热法还原制得金属铬的化学方程式是 。
(3)硫酸酸化的Na2Cr2O7和FeSO4反应,生成Cr3+等,该反应的离子方程式是 。
(4)某Na2Cr2O7样品2.00g恰好和4.56gFeSO4完全反应,该样品的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2011届广西河池高级中学高三第六次月考理综化学部分 题型:填空题
交警常用“司机饮酒检测仪”检查司机是否酒后驾车,其原理是硫酸酸化的重铬酸盐(Cr2O72-橙红色)和乙醇反应生成铬盐(Cr3+绿色)和乙酸等。重铬酸钠(Na2Cr2O7)在工业中有很广泛的应用,常用来制备金属铬。方法如下:
将铬铁矿[主要成分Fe(CrO2)2]与纯碱、氧气高温焙烧,除杂、酸化,得到重铬酸钠,碳和重铬酸钠在高温下反应生成Cr2O3、Na2CO3和CO,Cr2O3再经铝热法还原,即可制得金属铬。请回答:
(1)硫酸酸化的K2Cr2O7和乙醇反应的化学方程式是 。
(2)写出碳和重铬酸钠高温反应的化学方程式 。
Cr2O3经铝热法还原制得金属铬的化学方程式是 。
(3)硫酸酸化的Na2Cr2O7和FeSO4反应,生成Cr3+等,该反应的离子方程式是 。
(4)某Na2Cr2O7样品2.00g恰好和4.56gFeSO4完全反应,该样品的纯度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com