
���� n/mol T/�� | ����̿ | NO | E | F |
| ��ʼ | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
���� ��1����Ӧ��C��CO2��̼Ԫ�ػ��ϼ���0������Ϊ+4�ۣ�������4�ۣ�KMnO4��MnSO4��MnԪ�ػ��ϼ���+7�۽���Ϊ+2�ۣ�������5�ۣ����ϼ�������С������Ϊ20����C��ϵ��Ϊ5����KMnO4ϵ��Ϊ4���ݴ˽��ԭ���غ���ƽ�������ʵ�ϵ����
��2���ɱ������ݿ�֪��C��NO��E��F�Ļ�ѧ������֮��Ϊ0.03��0.06��0.03��0.03=1��2��1��1����Ӧ��C�����������ԭ���غ��֪������ΪN2��CO2���Ҹ÷�ӦΪ���淴Ӧ���ʷ�Ӧ����ʽΪ��C+2NO?N2+CO2��
�ټ���������ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽK=$\frac{c��{N}_{2}����c��C{O}_{2}��}{{c}^{2}��NO��}$���㣻
���ɱ������ݿ�֪���¶���T1��ΪT2��ƽ�����淴Ӧ�ƶ�����������Ӧ�����ȣ����Ƿ��Ȳ�ȷ���������ж��¶ȱ仯��
��3������֪����CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ/mol
��2H2O ��g���T2H2��g��+O2��g����H=+484kJ/mol��
���ݸ�˹���ɣ����2-��ɵã�2CO��g��+O2��g���T2CO2��g����
��ƽ��ʱCO��O2��CO2�����ʵ����ֱ�Ϊ4mol��2mol����4mol�������¶Ⱥ�ѹǿ���䣬���������ʵ���֮��Ϊ2��1��2ʱ����ƽ��״̬��
A��CO��O2��CO2�����ʵ����ֱ�Ϊ5mol��2.5mol��5molʱ����ƽ��״̬��������1mol��ЧΪǰ��ƽ��Ļ���������0.5molO2��
B�����ʵ������ӱ� CO��O2��CO2��Ũ��֮����ԭƽ����ͬ��2��1��2��ƽ�ⲻ�ƶ���
C��CO��O2��CO2�����ʵ����ֱ�Ϊ3mol��1.5mol��3molʱ����ƽ��״̬��������1mol��ЧΪǰ��ƽ��Ļ���������0.5molO2��
D�����ʵ��������룬CO��O2��CO2��Ũ��֮����ԭƽ����ͬ��2��1��2��ƽ�ⲻ�ƶ���
��4����H2C2O4Ϊ��Ԫ��ǿ�ᣬHC2O4-����Һ�мȷ��������ַ���ˮ�⣻
��a�����������غ��жϣ�
b�����ݵ���غ��жϣ�
c�����������غ㡢����غ��жϣ�
d����ǡ�÷�Ӧ��c��K+��=c��Na+������ʱ��Һ�ʼ��ԣ��ʼ�����������Ƶ����ʵ�������Щ��
��� �⣺��1����Ӧ��C��CO2��̼Ԫ�ػ��ϼ���0������Ϊ+4�ۣ�������4�ۣ�KMnO4��MnSO4��MnԪ�ػ��ϼ���+7�۽���Ϊ+2�ۣ�������5�ۣ����ϼ�������С������Ϊ20����C��ϵ��Ϊ5����KMnO4ϵ��Ϊ4�����ԭ���غ���ƽ��ʽΪ��5C+4KMnO4+6H2SO4=5CO2��+4MnSO4+2K2SO4+6H2O��
�ʴ�Ϊ��5��4��6��5��4��2��6��
��2���ɱ������ݿ�֪��C��NO��E��F�Ļ�ѧ������֮��Ϊ0.03��0.06��0.03��0.03=1��2��1��1����Ӧ��C�����������ԭ���غ��֪������ΪN2��CO2���Ҹ÷�ӦΪ���淴Ӧ���ʷ�Ӧ����ʽΪ��C+2NO?N2+CO2��
��ƽ��ʱc��NO��=$\frac{0.04mol}{2L}$=0.02mol/L��c��N2��=c��CO2��=$\frac{0.03mol}{2L}$=0.015mol/L����T1��ʱ�÷�Ӧ��ƽ�ⳣ��ΪK1=$\frac{c��{N}_{2}����c��C{O}_{2}��}{{c}^{2}��NO��}$=$\frac{0.015��0.015}{0.0{2}^{2}}$=$\frac{9}{16}$��
�ʴ�Ϊ��$\frac{9}{16}$��
���ɱ������ݿ�֪���¶���T1��ΪT2��ƽ�����淴Ӧ�ƶ�����������Ӧ�����ȣ����Ƿ��Ȳ�ȷ�������ж��¶ȱ仯��
�ʴ�Ϊ��c��
��3������֪����CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ/mol
��2H2O ��g���T2H2��g��+O2��g����H=+484kJ/mol��
���ݸ�˹���ɣ����2-��ɵã�2CO��g��+O2��g���T2CO2��g����H=-566 kJ/mol
�ʴ�Ϊ��2CO��g��+O2��g���T2CO2��g����H=-566 kJ/mol
��ƽ��ʱCO��O2��CO2�����ʵ����ֱ�Ϊ4mol��2mol����4mol�������¶Ⱥ�ѹǿ���䣬���������ʵ���֮��Ϊ2��1��2ʱ����ƽ��״̬��
A��CO��O2��CO2�����ʵ����ֱ�Ϊ5mol��2.5mol��5molʱ����ƽ��״̬��������1mol��ЧΪǰ��ƽ��Ļ���������0.5molO2��ƽ�������ƶ�����A���ϣ�
B�����ʵ������ӱ� CO��O2��CO2��Ũ��֮����ԭƽ����ͬ��2��1��2��ƽ�ⲻ�ƶ�����B�����ϣ�
C��CO��O2��CO2�����ʵ����ֱ�Ϊ3mol��1.5mol��3molʱ����ƽ��״̬��������1mol��ЧΪǰ��ƽ��Ļ���������0.5molO2��ƽ�������ƶ�����C�����ϣ�
D�����ʵ��������룬CO��O2��CO2��Ũ��֮����ԭƽ����ͬ��2��1��2��ƽ�ⲻ�ƶ�����D�����ϣ�
��ѡ��A��
��4����H2C2O4Ϊ��Ԫ��ǿ�ᣬHC2O4-����Һ�з���������ˮ�⣬������ƽ�⣺HC2O4-+H2O?H2C2O4+OH-��
�ʴ�Ϊ��HC2O4-+H2O?H2C2O4+OH-��
��a��̼Ԫ������Һ�д�����ʽ�У�HC2O4-��H2C2O4��C2O42-�����������غ���c��K+��=c��HC2O4-��+c��H2C2O4��+c��C2O42-������a��ȷ��
b�����ݵ���غ��У�c��K+��+c��Na+��+c��H+��=c��HC2O4-��+2c��C2O42-��+c��OH-������Һ�����ԣ���c��H+��=c��OH-������c��K+��+c��Na+��=c��HC2O4-��+2c��C2O42-������b����
c����c��K+��=c��HC2O4-��+c��H2C2O4��+c��C2O42-����c��K+��+c��Na+��=c��HC2O4-��+2c��C2O42-����֪��c��Na+��=c��C2O42-��-c��H2C2O4������c����
d����ǡ�÷�Ӧ��c��K+��=c��Na+������ʱ��Һ�ʼ��ԣ��ʼ�����������Ƶ����ʵ�������Щ����c��K+����c��Na+������d��ȷ��
�ʴ�Ϊ��ad��
���� ���⿼��������ԭ��Ӧ��ƽ��ƽ�ⳣ���ļ��������á���Чƽ�⡢�Ȼ�ѧ����ʽ��д������Ũ�ȴ�С�Ƚϵȣ���Ŀ�ۺ��Խϴ��Ƕ�ѧ���ۺ������Ŀ��飬��4��������Ũ�ȵıȽ���ע�������غ㡢����غ㡢���Ӻ��ʽ��Ӧ�ã��Ѷ��еȣ�


 �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д� ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
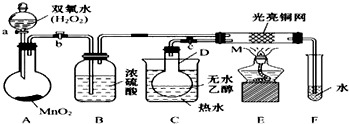
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢ� | C�� | �٢ڢܢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������ | B�� | ���� | C�� | �Ȼ�����Һ | D�� | ������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ����Ҷ��� | B�� | ���������� | C�� | ��������ϩ | D�� | ��������ȩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.2 mol•L-1��NaHCO3��Һ�У�c��Na+����c��HCO3-����c��OH-����c��H+����c��CO32-�� | |
| B�� | �������pH=4������ʹ���ϡ�ͳ�pH=5����Һ��������ӵ�ˮ���� | |
| C�� | ��ˮ����ε�����������Һ��pH=7������Һ�У�c��NH4+��=c��Cl-�� | |
| D�� | pH=1��NaHSO4��Һ��c��H+��=c��SO42-��ʮc��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ư�ۿ��Ծ�������ˮ | |
| B�� | ͭ�Ľ����Ա����������Կ���ͭ������������Ũ���� | |
| C�� | �ϳ���ά���ά�����˹��ϳɵ��л��߷��ӻ����� | |
| D�� | ��ҵ�Ͽ���ʯ�����úȼ���γɵ��������������������Ƶ�ʯ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com