
| A.向氯水中通入少量二氧化硫,氯水的漂白性增强 |
| B.氯水中加入NaCl固体,对溶液的pH无影响 |
| C.常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L |
| D.向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-=2CO2↑+Cl-+ClO-+H2O |
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:不详 题型:单选题
| A.SiO2(制光纤) | B.Si和Ge(半导体材料) |
| C.钢化玻璃(汽车窗玻璃) | D.氮化硅陶瓷(制导热剂) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.乙醇与乙酸的酯化反应 | B.甲烷与氧气的反应 |
| C.铁与氯气的反应 | D.次氯酸的分解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

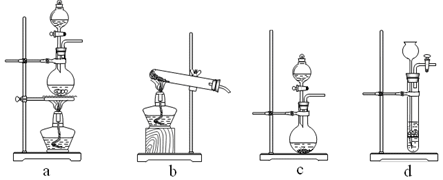

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.煤的干馏、石油的分馏都是物理变化 |
| B.工业上常用澄清石灰水和氯气反应制漂白粉 |
| C.蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,都属于“盐析” |
| D.二氧化硅可以用于制造光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用SO2漂白食品 |
| B.自来水中通入少量Cl2进行消毒杀菌 |
| C.用小苏打(NaHCO3)发酵面团制作馒头 |
| D.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
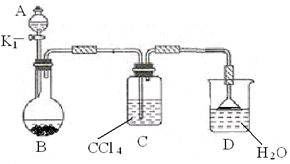
 的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
查看答案和解析>>
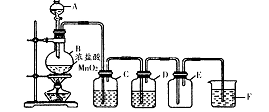
科目:高中化学 来源:不详 题型:实验题
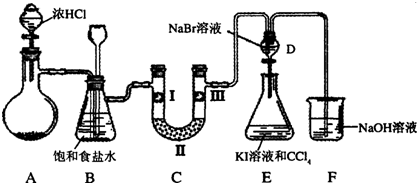
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
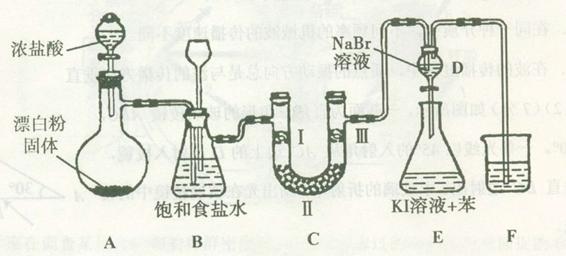
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com