
【题目】下图虚线框中的装置可用来检验浓硫酸与木炭粉的加热条件下反应产生的所有气体产物,填写下列空白:
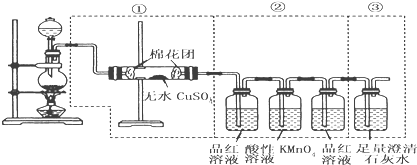
(1)如果装装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检出的物质是____________;不能检出的物质是____________。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是____________;不能检出的物质是____________。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是____________;不能检出的物质是____________。
【答案】 SO2、CO2 H2O H2O SO2、CO2 SO2、CO2 H2O
【解析】木炭粉与浓硫酸反应生成SO2和CO2,方程式为:C+2H2SO4(浓)![]() S02↑+C02↑+2H2O,SO2能使品红溶液褪色,SO2也能使酸性高锰酸钾溶液褪色,通过酸性高锰酸钾溶液除去SO2,CO2不能使品红溶液褪色,CO2也不能酸性高锰酸钾溶液褪色。无水硫酸铜遇水变蓝,二氧化硫、二氧化碳都能使澄清石灰水变浑浊.据此即可解答。
S02↑+C02↑+2H2O,SO2能使品红溶液褪色,SO2也能使酸性高锰酸钾溶液褪色,通过酸性高锰酸钾溶液除去SO2,CO2不能使品红溶液褪色,CO2也不能酸性高锰酸钾溶液褪色。无水硫酸铜遇水变蓝,二氧化硫、二氧化碳都能使澄清石灰水变浑浊.据此即可解答。
(1)①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝色的五水合硫酸铜,②中SO2能使品红溶液褪色,SO2也能使酸性高锰酸钾溶液褪色,③中二氧化硫、二氧化碳都能使澄清石灰水变浑浊。如果装置中①、②、③三部分仪器的连接顺序改为②、①、③,通过②中品红溶液褪色,说明有SO2,通过酸性高锰酸钾溶液除去SO2,再通过品红溶液,品红不褪色,说明二氧化硫已经除尽,通过①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝色的五水合硫酸铜,但不能说明是生成的水,可能是溶液中的水,通过③澄清石灰水,石灰水变浑浊,说明有二氧化碳生成;
(2)如果将仪器的连接顺序变为①、③、②,通过①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝色的五水合硫酸铜,能说明有水生成,通过③澄清石灰水,石灰水变浑浊,二氧化硫、二氧化碳都能使澄清石灰水变浑浊,不可以检出二氧化硫、二氧化碳;
(3)如果将仪器的连接顺序变为②、③、①,通过②中品红溶液褪色,说明有SO2,通过酸性高锰酸钾溶液除去SO2,再通过品红溶液,品红不褪色,说明二氧化硫已经除尽,通过③澄清石灰水,石灰水变浑浊,说明有二氧化碳生成,通过①中装有无水硫酸铜,无水硫酸铜遇水由白色变成蓝色的五水合硫酸铜,但不能说明是生成的水,可能是溶液中的水。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份。一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42-完全沉淀,则原溶液中NO3-的物质的量浓度为(单位均为mol·L-1)
A. (c-2b)/a B. (2b-4c)/a C. (2b-c)/a D. (b-4c)/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)镓(Ga)与铝同族,写出镓的氯化物和氨水反应的化学方程式____________。
(2)硅与铝同周期,SiO2是硅酸盐玻璃 (Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式____________________________________________。长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同,由钠长石化学式NaAlSi3O8可推知钙长石的化学式为_______________________。
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法 如:2Al+4BaO![]() 3Ba↑+BaO·Al2O3,常温下Al的金属性比Ba的金属性______(选填“强”“弱”)。利用上述方法可制取Ba的主要原因是________。
3Ba↑+BaO·Al2O3,常温下Al的金属性比Ba的金属性______(选填“强”“弱”)。利用上述方法可制取Ba的主要原因是________。
A.高温时Al的活泼性大于Ba B.高温有利于BaO分解
C.高温时BaO·Al2O3比Al2O3稳定 D.Ba的沸点比Al的低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常把铝粉与某些金属氧化物的混合物称为铝热剂,下列氧化物中不能与铝粉发生铝热反应的是( )
A.Na2OB.Cr2O3C.MnO2D.V2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 合成氨反应是放热反应,所以工业上采用低温条件以提高氨的产率
B. 钢铁水闸可用牺牲阳极或外加电流的阴极保护法延缓其腐蚀
C. Na2O2与水反应产生1 mol O2,理论上转移的电子数约为4×6.02×1023
D. 保持温度不变,向稀氨水中缓慢通入CO2,溶液中![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是
A. 氯化铵的电子式为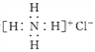
B. 乙酸分子的结构式: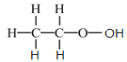
C. 按系统命名法,![]() 的名称为2,5-二甲基-3-乙基庚烷
的名称为2,5-二甲基-3-乙基庚烷
D. 四氯化碳分子的比例模型:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用硼镁泥为原料制取MgSO4·7H2O粗产品的过程如下:
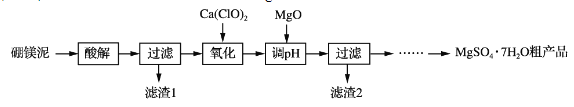
硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
(1)“酸解”时为提高Mg2+的浸出率,可采用的措施是_____(写一种)。所加酸不宜过量太多的原因是_____。
(2)“氧化”步骤中,若用H2O2代替Ca(ClO)2,则发生反应的离子方程式为______________。实际未使用H2O2,除H2O2成本高外,还可能的原因是______________________________________。
(3)“调pH”时用MgO而不用NaOH溶液的原因是________________________。
(4)结合附表信息,由MgSO4·7H2O粗产品(含少量CaSO4)提纯获取MgSO4·7H2O的实验方案如下:将粗产品溶于水,_________________________________________________,室温下自然挥发干燥。(实验中必须使用的试剂有:饱和MgSO4溶液,乙醇)附:两种盐的溶解度(g/100 g水)
温度℃ | 10 | 30 | 40 | 50 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前20号元素W、X、Y、Z的原子序数依次增大,且分列四个不同周期和四个不同主族。其中A为Y元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物;常温下乙为液体。下列说法正确的是
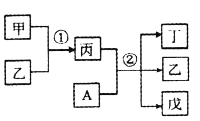
A. 简单离子半径:Z>Y
B. 反应①为吸热反应
C. 反应②为工业上制备漂白粉的反应原理
D. X、Y分别与Z形成的化合物中,化学键类型一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准 状况下测定)。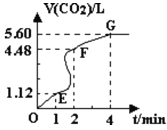
请回答下列问题:
(1)设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速率为v3,则v1、v2、v3从大到小的顺序为________。
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是______(填字母)。
A.蒸馏水 B.氯化钾固体 C.氯化钠溶液 D.浓盐酸
(3)加入CaCO3的质量为 ______。
(4)若反应过程中溶液体积的变化忽略不计,则EF段用盐酸表示的化学反应速率v(HCl)=___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com