
【题目】物质A有如图所示的转化关系(部分产物已略去),已知H能使溴的CCl4溶液褪色。
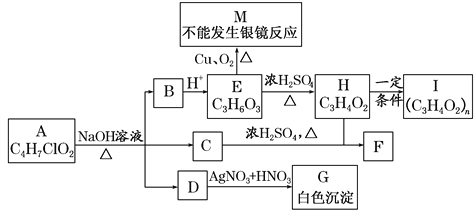
回答下列问题:
(1)A的结构简式为________。
(2)1 mol E与足量NaOH溶液反应时,消耗NaOH的物质的量为________mol。
(3)M的某些同分异构体能发生银镜反应,写出其中任意一种结构简式:________________。
(4)写出化学方程式H―→I:__________________________________。
(5)E通常可由丙烯、NaOH溶液、H2、O2、Br2等为原料合成,请按“A―→B―→C―→…”的形式写出反应流程,并在“―→”上注明反应类型但不需要注明试剂及反应条件________。
【答案】 CH3CHClCOOCH3 1 OHCCH2COOH、OHCCH(OH)CHO、OHCCOOCH3(任选一种即可,其他合理答案均可) 
【解析】H在一定条件下反应生成I,反应前后各元素的组成比不变,且H能使溴的![]() 溶液褪色,说明H反应生成I应为加聚反应,说明H中含有
溶液褪色,说明H反应生成I应为加聚反应,说明H中含有![]() ,则H为
,则H为![]() ,I为
,I为![]() ;由此可以知道E应为
;由此可以知道E应为![]() ,被氧化生成
,被氧化生成![]() ,不能发生银镜反应,B应为
,不能发生银镜反应,B应为![]() ,说明A在碱性条件下生成
,说明A在碱性条件下生成![]() 、NaCl和醇,对比分子组成可以知道该醇为
、NaCl和醇,对比分子组成可以知道该醇为![]() ,则A应为
,则A应为![]() 。
。
(1)由以上分析可以知道A为CH3CHClCOOCH3 ;正确答案:CH3CHClCOOCH3 。
(2)E为![]() ,分子中只有
,分子中只有![]() 具有酸性,能与NaOH反应,则
具有酸性,能与NaOH反应,则![]() 与足量的NaOH溶液反应时,消耗NaOH物质的量为
与足量的NaOH溶液反应时,消耗NaOH物质的量为![]() ;正确答案:1。
;正确答案:1。
(3)M为![]() ,其对应的同分异构体能发生银镜反应,说明分子中含有CHO或
,其对应的同分异构体能发生银镜反应,说明分子中含有CHO或![]() 等官能团,对应的同分异构体可能有OHCCH2COOH、OHCCH(OH)CHO或OHCCOOCH3;正确答案: OHCCH2COOH、OHCCH(OH)CHO、OHCCOOCH3(任选一种即可,其他合理答案均可)。
等官能团,对应的同分异构体可能有OHCCH2COOH、OHCCH(OH)CHO或OHCCOOCH3;正确答案: OHCCH2COOH、OHCCH(OH)CHO、OHCCOOCH3(任选一种即可,其他合理答案均可)。
(4)H为![]() ,可发生加聚反应生成
,可发生加聚反应生成![]() ,方程式为n
,方程式为n![]()
![]()
![]() ;正确答案:
;正确答案: 。
。
(5) 由丙烯、NaOH溶液、![]() 、
、![]() 、
、![]() 等为原料合成
等为原料合成![]() ,可涉及以下反应流程:
,可涉及以下反应流程: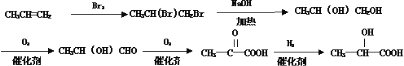 ,涉及的反应类型有加成、水解(或取代)、氧化、氧化、还原(或加成);具体流程如下:
,涉及的反应类型有加成、水解(或取代)、氧化、氧化、还原(或加成);具体流程如下:
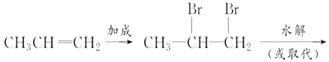
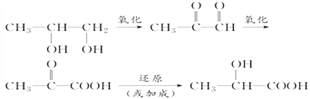 ;正确答案:
;正确答案:
 。
。


科目:高中化学 来源: 题型:
【题目】镓(Ga)位于周期表的第四周期,与Al同主族,主要存在Ga3+、GaO2-两种离子形态,被广泛应用于电子工业。
(1)Ga的原子序数为______。
(2)半导体材料氮化稼是由Ga与NH3在一定条件下合成的,该过程中每生成3molH2时,就会放出30.8kJ的热量。
①反应的热化学方程式是________。
②反应的化学平衡翻常数表决达式是_________________。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是_____(填字母代号).

A.Ⅰ图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B.Ⅱ图象中纵坐标可以为稼的转化率
C.Ⅲ图象中纵坐标可以为化学反应速率
D.Ⅳ图象中纵坐标可以为体系内混合气体的平均相对分子质量
(3)工业上多用电解精炼法提纯稼。具体原理如下图所示:

已知:金属的活动性Zn>Ga>Fe>Cu
①X为电源的_____极,电解精炼稼时阳极泥的成分是__________;
②在电解过程中使某种离子迁移到达阴极并在阴极放电析出高纯稼, 请写出该电解过程中的电极反应方程式:阳极_________;阴极_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是
A. 用药匙取用少量Na2SO4固体
B. 用胶头滴管滴加少量NaCl溶液
C. 用酒精灯直接加热试管、蒸发皿
D. 用10mL量筒量取8.50mL1.0 mol·L-1NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:
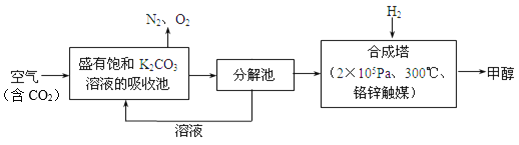
(1)分解池中主要物质是_______________。
(2)在合成塔中,若有4400 g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370 kJ的热量,写出该反应的热化学方程式_______________。
(3)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”_______________。
(4)一定条件下,往2L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:
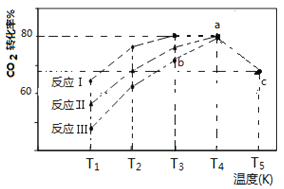
(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是________(填“反应I”,“反应II”,“反应III”)。
②b点v (正)_________v (逆)(填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是____________。
④c点时该反应的平衡常数K =____________________。
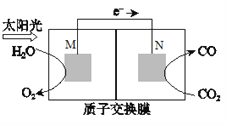
(5)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图给出了8种有机化合物的转化关系,请回答下列问题:
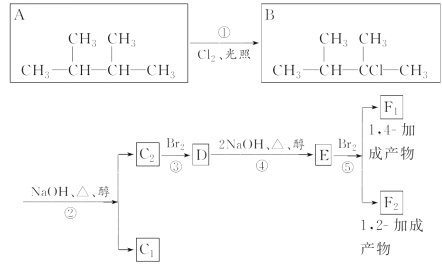
(1)根据系统命名法,化合物A的名称是________。
(2)上述框图中,①是________反应,③是________反应。(填反应类型)
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:___________________。
(4)C2的结构简式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是
A. 以铁作阳极,铂作阴极,电解饱和食盐水,可以制备烧碱
B. 25℃下,在NH3·H2O稀溶液中加水稀释,![]() 的值不变
的值不变
C. 工业生产硫酸时,接触室催化氧化S02时使用热交换器可以充分利用热量,降低生产成本
D. 反应![]() 室温下不能自发进行,则△H>0
室温下不能自发进行,则△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下(T2> Tl),在3个体积均为2.0 L的恒容密闭容器中反应 2NO(g)+ Cl2(g) = 2ClNO(g)(正反应放热)达到平衡,下列说法正确的是

A. 达到平衡时,容器I与容器II中的总压强之比为1:2
B. 达到平衡时,容器III中ClNO的转化率小于80%
C. 达到平衡时,容器II中c(ClNO(/ c(NO)比容器I中的大
D. 若温度为Tl,起始时向同体积恒容密闭容器中充入0.20 mol NO(g)、0.2 mol Cl2(g)和0.20 mol ClNO(g),则该反应向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室以木炭、浓硝酸、Na2O2为主要原料按照如图所示装置制各亚硝酸钠(加热装置及部分夹持装置已略去),反应原理为:2NO+Na2O2=2NaNO2。
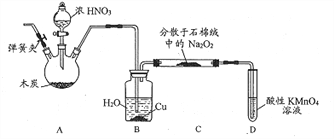
回答下列问题:
(1)A装置中反应的化学方程式为__________________。
(2)B装置中铜的作用是__________________。
(3)充分反应后,C中生成的固体除NaN02外,还可能有杂质生成,应在B、C之间加一个装置,该装置所盛放试剂的名称是_________________。
(4)检查装置气密性并装入药品后,以下实验操作步骤正确的顺序为____________________填标号)。
a.打开弹簧夹,向装置中通入N2 b.点燃酒精灯
c.向三颈烧瓶中滴加浓硝酸 d.熄灭酒精灯
e.关闭分液漏斗旋塞 f.停止通入N2
(5)D装置用于尾气处理,写出D中反应的离子方程式:___________________。
(6)利用改进后的装置,将7.8gNa2O2完全转化成NaNO2,理论上至少需要木炭____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.玫瑰的香味物质中包含苧烯,苧烯的键线式为![]()
(1)写出苧烯跟等物质的量的Br2发生加成反应所得产物的可能的结构:________________________(用键线式表示)。
(2)有机物A是苧烯的同分异构体,分子中含有![]() 结构,A可能的结构有____种。
结构,A可能的结构有____种。
II.某烃键线式为![]() ,该烃与Br2以物质的量之比1: l加成时,所得产物有_______种。
,该烃与Br2以物质的量之比1: l加成时,所得产物有_______种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com