
【题目】实验室用密度为1.25gmL﹣1、质量分数为36.5%的浓盐酸配制240mL 0.1molL﹣1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为 .
(2)配制 240mL 0.1molL﹣1 的盐酸
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次 ) .
A.用30mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线12cm处
(4)若实验中遇到下列情况,对盐酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用于稀释盐酸的烧杯未洗涤, .
②容量瓶中原有少量蒸馏水, .
③定容时观察液面俯视, .
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度 .
②向容量瓶中转移溶液时有滚液不慎有溶液溅出 .
③定容摇勻后发现液面下降 .
【答案】
(1)12.5mol.L﹣1
(2)2.0,250
(3)BCAFED
(4)偏低,不变,偏高
(5)重新配置,重新配置,无需再配
【解析】解:(1)浓盐酸的物质的量浓度为 ![]() =12.5mol/L,
=12.5mol/L,
所以答案是:12.5mol.L﹣1;
(2)配制240mL0.1molL﹣1的盐酸,应选择250mL容量瓶,实际配制250mL溶液,设需要浓盐酸体积为V,则依据溶液稀释过程 中溶质的物质的量不变得:V×12.5mol/L=0.1mol/L×250mL,解得V=2.0mL;
所以答案是:2.0;250;
(3)配制一定物质的量浓度的溶液步骤:计算、称量、溶解、转移、洗涤、定容、摇匀等,故正确的顺序为:BCAFED;
所以答案是:BCAFED;
(4)①用以稀释浓硫酸的烧杯未洗涤,导致溶质偏少,浓度偏低;②容量瓶中原有少量蒸馏水,对溶液的浓度无影响,溶液的浓度不变;③定容时观察液面俯视,导致溶液的体积偏小,溶液的浓度偏高;
所以答案是:偏低;不变;偏高;
(5)①定容时加蒸馏水时超过了刻度,溶液的浓度偏小,需要重新配置;②向容量瓶中转移溶液时有滚液不慎有溶液溅出,溶液的浓度偏小,需要重新配置;③定容摇勻后发现液面下降,溶液的浓度不变;
所以答案是:重新配置;重新配置;无需再配.
【考点精析】解答此题的关键在于理解配制一定物质的量浓度的溶液的相关知识,掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】已知如表数据:
化学式 | 电离平衡常数(25℃) |
HCN | K=5.0×10﹣10 |
H2CO3 | K1=4.4×10﹣7 , K2=4.7×10﹣11 |
向NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: 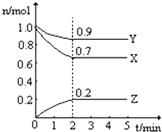
(1)该反应的化学方程式为;
(2)从开始至2min,Z的平均反应速率为;
(3)若X、Y、Z均为气体,反应达平衡时:此时体系的压强是开始时的倍.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】21世纪是钛的世纪.在800℃~1000℃时电解TiO2可制得钛,装置如图所示.下列叙述正确的是( ) 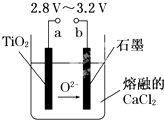
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为:TiO2+4e﹣═Ti+2O2﹣
D.每生成0.1mol钛,转移电子0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( ) 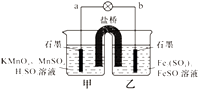
A.乙烧杯中发生还原反应
B.甲烧杯中溶液的pH逐渐减小
C.电池工作时,盐桥中的SO42﹣移向甲烧杯
D.外电路的电流方向是从a到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析.具体步骤如图所示: 
①加入过量氨水后发生反应的离子方程式为: .
②操作b为:
③Al(NO3)3待测液中,c(Al3+)=mol/L(用含m、V的代数式表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示: 
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050、 |
沸点/℃ | 892 | 444.6 | 2980 |
①根据表数据,请你判断该电池工作的适宜应控制在(填字母)范围内.
A.100℃以下 B.100~300℃C.300~350℃D.350~2050℃
②放电时,电极A为极,电极B发生反应(填“氧化或还原”)
③充电时,总反应为Na2SX═2Na+xS(3<x<5),则阳极的电极反应式为: .
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开.通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.则右侧发生的电极方程式:;试分析左侧溶液蓝色逐渐变浅的可能原因是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源的开发利用与人类社会的可持续性发展息息相关.
(1)①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=a kJmol﹣1
②CO(g)+ ![]() O2(g)=CO2(g)△H2=b kJmol﹣1
O2(g)=CO2(g)△H2=b kJmol﹣1
③4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJmol﹣1
则C的燃烧热kJmol﹣1
依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是(填序号).
A.C(s)+CO2(g)═2CO(g)
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)
C.2H2O(l)═2H2(g)+O2(g)
D.2CO(g)+O2(g)═2CO2(g)
若以熔融的K2C03与C02为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应: .
(2)某实验小组模拟工业合成氨反应N2+3H2 ![]() 2NH3 △H=92.4 kJmol﹣1 , 开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中.反应前压强为P.,反应过程中压强用P表示,反应过程中P/P.与时间t的关系如图2所示.请回答下列问题:
2NH3 △H=92.4 kJmol﹣1 , 开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中.反应前压强为P.,反应过程中压强用P表示,反应过程中P/P.与时间t的关系如图2所示.请回答下列问题: 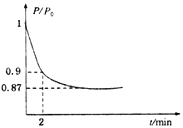
①反应达平衡的标志是(填字母代号) .
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为 .
③若提高N2的转化率可采取的措施有 .
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大
E.加入一定量的N2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题: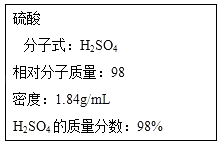
如图为实验室某浓硫酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
(1)该浓硫酸中H2SO4的物质的量浓度为
(2)某学生欲用上述浓硫酸和蒸馏水配制250mL物质的量浓度为0.4molL﹣1的稀硫酸,该学生需要量取上述浓硫酸进行配制.
(3)为配制(2)中的稀硫酸,下列可供选用的仪器中,一定用到的是(填编号),配制过程中还缺少的仪器是(填写仪器名称)
①玻璃棒;②胶头滴管;③量筒;④药匙;⑤圆底烧瓶;⑥天平;⑦烧杯;⑧普通漏斗
(4)取上述配制好的硫酸溶液50mL与足量的铝反应,所得溶液中c(Al3+)=(忽略溶液体积的变化),检验溶液中SO42﹣存在的方法: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com