
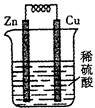
| A.溶液中的H+定向移动到正极 |
| B.铜片逐渐溶解,质量减轻 |
| C.锌片为负极 |
| D.该装置可以将化学能转化为电能 |
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:单选题
| A.常温条件下,在空气中铝不容易被腐蚀 |
| B.镀锌铁片比镀锡铁片更耐腐蚀 |
| C.用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 |
| D.远洋海轮的尾部装上一定数量的锌板 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
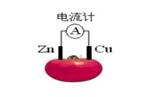
| A.一段时间后,锌片质量会变小 | B.铜电极是该电池的负极 |
| C.电子由铜通过导线流向锌 | D.锌电极是该电池的正极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 正极 | Zn | Cu | Zn | Cu |
| 负极 | Cu | Zn | Cu | Zn |
| 电解质溶液 | CuCl2 | CuCl2 | ZnCl2 | ZnCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是 。电池的总反应可表示为:
。电池的总反应可表示为:
A.该电池工作时,正极反应为: |
B.锂电极作该电池负极,负极反应为: |
| C.该电池工作时,电子通过外电路从正极流向负极 |
| D.该电池组装时,必须在无水无氧条件下进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Pb为正极被氧化 | B.SO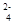 只向PbO2极移动 只向PbO2极移动 |
| C.电解质溶液密度不断减小 | D.溶液的pH值不断减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为2MnO2 + H2O+2e-==Mn2O3 + 2OH- |
| C.外电路中每通过0.2mol电子,锌的质量理论上减少13g |
| D.电池工作时,电子由负极通过外电路流向正极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.烧杯a中的溶液pH升高 | B.锌是化学电源的正极 |
| C.烧杯a中发生的反应为2H++2e-=H2↑ | D.盐桥中的阳离子向铁电极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com