
| A. | 正反应速率增大 | B. | 反应物浓度减小 | ||
| C. | K值减小 | D. | 正反应速率大于逆反应速率 |
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
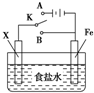
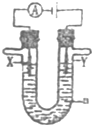
| A. | 若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 | |
| B. | 若 X 为锌棒,开关 K 置于 A 或 B 处均可减缓铁的腐蚀 | |
| C. | 若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| D. | 若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到铁棒附近先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中H+、NH4+、NO3-、Cl-可以大量共存 | |
| B. | Cu(NH3)4SO4中呈正四面体的原子团只有SO42- | |
| C. | 滴加Na2CO3溶液产生CuCO3蓝色沉淀 | |
| D. | 硫酸铜溶液与氨水作用后可缓缓加入乙醇可产生晶体,其产生晶体的主要原理是CuSO4+4NH3═[Cu(NH3)4]SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发 | B. | 过滤 | C. | 萃取 | D. | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
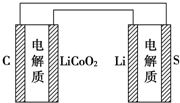 已知电池的比能量是参与电极反应的单位质量的电极材料放出电能的大小.有关下述两种电池说法正确的是( )
已知电池的比能量是参与电极反应的单位质量的电极材料放出电能的大小.有关下述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂硫电池充电时,锂电极发生还原反应 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 如图表示用锂离子电池给锂硫电池充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
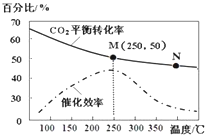
| A. | 生成乙烯的速率:v(M)一定小于v(N) | |
| B. | 化学平衡常数:KN>KM | |
| C. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
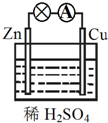
| A. | Zn为正极,Cu为负极 | B. | 该装置将化学能转变为电能 | ||
| C. | 正极反应式为Cu-2e-═Cu2+ | D. | 电子由铜片通过导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)CH3OH是一种可燃性的液体.
(1)CH3OH是一种可燃性的液体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com