
����Ŀ���Ժ�1��̼ԭ�ӵ�����(��CO��CO2��CH4��CH3OH��)Ϊԭ�ϵ�̼һ��ѧ����δ����ѧ��ҵ�ĺ��ģ���Ϊ��ѧ���о�����Ҫ���⡣
(1))��֪CO��H2��CH3OH(g)��ȼ���ȷֱ�Ϊ-283.0 kJ��mol��1��-285.8 kJ��mol��1��-764.5 kJ��mol��1����Ӧ��CO(g)��2H2(g)![]() CH3OH(g)����H��_____����
CH3OH(g)����H��_____����
(2)��T1ʱ�������Ϊ2 L�ĺ��������г������ʵ���֮��Ϊ3 mol��CO��H2��������ӦCO(g)��2H2(g)![]() CH3OH(g)����Ӧ�ﵽƽ��ʱCH3OH(g)���������(��)��n(H2)/n(CO)�Ĺ�ϵ��ͼ��ʾ��
CH3OH(g)����Ӧ�ﵽƽ��ʱCH3OH(g)���������(��)��n(H2)/n(CO)�Ĺ�ϵ��ͼ��ʾ��
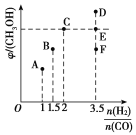
�ٵ���ʼn(H2)/n(CO)��2ʱ������5 min�ﵽƽ�⣬CO��ת����Ϊ0.6����0��5 min��ƽ����Ӧ����v(H2)��______�����˿����������м���CO(g)��CH3OH(g)��0.4 mol���ﵽ��ƽ��ʱH2��ת���ʽ�____(�������С�����䡱)��
�ڵ�n(H2)/n(CO)��3.5ʱ���ﵽƽ���CH3OH���������������ͼ���е�________(����D����E������F��)�㡣
(3)��һ�ݻ��ɱ���ܱ������г���10 mol CO��20 mol H2��CO��ƽ��ת����(��)���¶�(T)��ѹǿ(p)�Ĺ�ϵ��ͼ��ʾ��
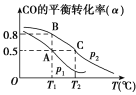
��A��B��C�����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ________��
�����ﵽƽ��״̬Aʱ�����������Ϊ10 L������ƽ��״̬Bʱ���������Ϊ_____L��
(4)�Լ״�Ϊ��Ҫԭ�ϣ��绯ѧ�ϳ�̼��������Ĺ���ԭ����ͼ��ʾ�����Դ�ĸ���Ϊ__(����A������B��)��д�������ĵ缫��Ӧʽ____��
���𰸡���90.1 kJ��mol��1 0.12 mol��L��1��min��1 ���� F KA��KB>KC 2 B 2CH3OH��CO��2e��===(CH3O)2CO��2H��
��������
(1)����CO ��H2��CH3OH��ȼ��������д�ȷ���ʽ�������ø�˹���ɼ���CO(g)��2H2(g)![]() CH3OH(g)������H��
CH3OH(g)������H��
(2) �ٸ���![]() �������ʣ�����Q��K�Ĺ�ϵ�жϷ�Ӧ���ڸ��ݺ��������У�Ͷ�ϱȵ���ϵ���ȣ��ﵽƽ��״̬ʱ����İٷֺ������
�������ʣ�����Q��K�Ĺ�ϵ�жϷ�Ӧ���ڸ��ݺ��������У�Ͷ�ϱȵ���ϵ���ȣ��ﵽƽ��״̬ʱ����İٷֺ������
(3) ����ͬ�¶���ƽ�ⳣ����ȣ�����ͼ��CO��ƽ��ת����(��)���¶����߶���С����֪�����¶�ƽ�������ƶ���
�ڸ���A��B�����ƽ�ⳣ����ȼ�����ƽ��״̬Bʱ�����������
��4���ɽṹʾ��ͼ��֪����������������Ӧ���Ҳ����ԭ��Ӧ����������Ϊ�������Ҳ�Ϊ������
��1����CO��g����H2��g����CH3OH��g����ȼ���ȡ�H�ֱ�Ϊ-283.0 kJ��mol��1��-285.8 kJ��mol��1��-764.5 kJ��mol��1����
��CO��g��+![]() O2��g��=CO2��g����H=-283.0 kJ��mol��1
O2��g��=CO2��g����H=-283.0 kJ��mol��1
��CH3OH��g��+![]() O2��g��=CO2��g��+2 H2O��l����H=-764.5 kJ��mol��1
O2��g��=CO2��g��+2 H2O��l����H=-764.5 kJ��mol��1
��H2��g��+![]() O2��g��=H2O��l����H=-285.8 kJ��mol��1
O2��g��=H2O��l����H=-285.8 kJ��mol��1
�ɸ�˹���ɿ�֪�â�+�ۡ�2-�ڵ÷�ӦCO��g��+2H2��g��=CH3OH��l����
�÷�Ӧ�ķ�Ӧ�ȡ�H=-283.0 kJ��mol��1+��-285.8 kJ��mol��1����2-��-764.5 kJ��mol��1��=��90.1 kJ��mol��1��
(2) �ٵ���ʼn(H2)/n(CO)��2ʱ������ʼn(H2) ��2mol��n(CO)��1mol������5 min�ﵽƽ�⣬CO��ת����Ϊ0.6��
CO(g)��2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ 0.5 1 0
ת�� 0.3 0.6 0.3
ƽ�� 0.2 0.4 0.3
![]() 0.12 mol��L��1��min��1
0.12 mol��L��1��min��1
K![]() 9.375
9.375
���˿����������м���CO(g)��CH3OH(g)��0.4 mol����![]() 7.8125��K�����Է�Ӧ������У��ﵽ��ƽ��ʱH2��ת���ʽ�����
7.8125��K�����Է�Ӧ������У��ﵽ��ƽ��ʱH2��ת���ʽ�����
�ڸ��ݺ��������У�Ͷ�ϱȵ���ϵ���ȣ��ﵽƽ��״̬ʱ����İٷֺ���������Ե�n(H2)/n(CO)��3.5ʱ���ﵽƽ���CH3OH���������������ͼ���е�F�㣻
(3) ����ͬ�¶���ƽ�ⳣ����ȣ�����KA=KB������ͼ��CO��ƽ��ת����(��)���¶����߶���С����֪�����¶�ƽ�������ƶ���ƽ�ⳣ����С������KB��KC����KA��KB>KC��
��A��B�����ƽ�ⳣ����ȣ���B�����������ΪVL
CO(g)��2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ 10 20 0
ת�� 5 10 5
ƽ�� 5 10 5
![]() ��
��
CO(g)��2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ 10 20 0
ת�� 8 16 8
ƽ�� 2 4 8
![]() ��V=2L��
��V=2L��
��4���ɽṹʾ��ͼ��֪����������������Ӧ���Ҳ����ԭ��Ӧ����������Ϊ���������ӵ�Դ���������Ҳ�Ϊ���������ӵ�Դ�ĸ�����BΪ��Դ�ĸ����������Ǽ״���COʧȥ�������ɣ�CH3



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ຬ��������ũ����������Ӫ�����ʡ�
��1����(N2H4)��N2O4�����ں������ķ��䡣��֪���з�Ӧ��
��N2(g)+O2(g) =2NO(g) ��H=+180kJ��mol��1
��2NO(g)+O2(g)![]() 2NO2(g) ��H=��112kJ��mol��1
2NO2(g) ��H=��112kJ��mol��1
��2NO2(g)![]() N2O4(g) ��H=��57kJ��mol��1
N2O4(g) ��H=��57kJ��mol��1
��2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g) ��H=��1136kJ��mol��1
��N2H4��O2��Ӧ���ɵ�����ˮ�������Ȼ�ѧ����ʽΪ_________________��
��2��һ���¶��£���ij�ܱ������г���1 mol NO2��������Ӧ��2NO2(g)![]() N2O4(g)����÷�Ӧ��ϵ���������������ѹǿ֮��Ĺ�ϵ��ͼ��ʾ��
N2O4(g)����÷�Ӧ��ϵ���������������ѹǿ֮��Ĺ�ϵ��ͼ��ʾ��
��a��b��c�����淴Ӧ�����ɴ�С��˳��Ϊ_______��ƽ��ʱ������ѹǿ���¶Ȳ��䣬������ϵ�м���һ������Ne����ƽ��_______�ƶ�(��������������������������)��
��a��ʱNO2��ת����Ϊ___________����ƽ���ѹ����ƽ��Ũ��Ҳ�����ƽ�ⳣ��Kp������¶���Kp=________Pa��1��
��3����֪��һ���¶��µĿ��淴ӦN2O4(g)![]() 2NO2(g)�У�v��=k��c(N2O4)��v��=k��c2(NO2)(k����k��ֻ���¶ȵĺ���)�������¶��µ�ƽ�ⳣ��K=10����k��=______k���������¶ȣ�k������ı���_______(������������С��������������)k������ı�����
2NO2(g)�У�v��=k��c(N2O4)��v��=k��c2(NO2)(k����k��ֻ���¶ȵĺ���)�������¶��µ�ƽ�ⳣ��K=10����k��=______k���������¶ȣ�k������ı���_______(������������С��������������)k������ı�����
��4�������Ǻϳ��ڶຬ�����ʵ�ԭ�ϣ�����H2��N2������ȼ�ϵ�أ���ѧ���Թ̵�øΪ�����������⻯øΪ����������X����ĤΪ��Ĥ�������������¼�ʵ���˺ϳ�NH3��ͬʱ����õ��ܡ��乤��ԭ��ͼ���£�

��XĤΪ___________����Ĥ�������ϵĵ缫��ӦʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����Ļ���������ܱ������з�����Ӧ mA��g��+nB��g��![]() pC��g���ﵽƽ����¶Ȳ��䣬�����������С��ԭ����1/3���ﵽƽ��ʱ��C��Ũ��Ϊԭ����2.5����������˵����ȷ����
pC��g���ﵽƽ����¶Ȳ��䣬�����������С��ԭ����1/3���ﵽƽ��ʱ��C��Ũ��Ϊԭ����2.5����������˵����ȷ����
A. C������������� B. A��ת���ʽ���
C. ƽ��������Ӧ�����ƶ� D. m+n��p
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a��b��c��d��e���ֶ�����Ԫ�ص�ԭ�Ӱ뾶������������֮��Ĺ�ϵ��ͼ��ʾ������˵����ȷ����(����)

A. �����Ӱ뾶��b>e
B. ���³�ѹ�£�a��c�γɵĻ�������ܳʹ�̬
C. ���ʷе㣺c<d
D. d��e���ܴ�����ͬһ���ӻ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������������������ӦΪ��2NO2(g)+O3(g)![]() N2O5(g)+O2(g)����Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ���ǣ� ��
N2O5(g)+O2(g)����Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ���ǣ� ��
A | B | C | D |
|
|
|
|
�����¶ȣ� | 0��3s�ڣ���Ӧ����Ϊ�� | t1ʱ����������� | ��ƽ��ʱ�����ı�x����xΪc(O2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺
A  B
B  C
C  D
D 
��1�����Ȼ�����Һ�еõ��Ȼ��ع��壬ѡ��װ��______(�����װ��ͼ����ĸ����ͬ)��
��2��Aװ���в����¶ȼƵIJ�����������Ϊ______��
��3���ӵ�ˮ�з����I2ѡ��װ��______�����뷽��������Ϊ____��______��
��4��װ��B�ڷ�ҺʱΪʹҺ��˳�����£��������⣬��Ӧ���еľ��������_____��
��5����ʵ������ȡ������ˮ�������������̵�ʵ�飺
![]()
![]()
![]()
![]()
![]() �D��
�D��![]()
�����к�Ca2����Mg2����Fe3����SO42�������ʣ���Ҫ�ᴿ������ۺ����á������ᴿ�IJ����У��ټ��������Na2CO3��Һ���ڼ��������BaCl2��Һ���ۼ��������NaOH��Һ�������������������Һ��pH����7�����ܽ⡡���ˡ�����������ȷ�IJ���˳����____________(��ѡ����ĸ)��
a���ݢۢ٢ޢڢܢ� b���ݢ٢ڢۢޢܢ� c���ݢڢ٢ۢܢޢ� d���ݢۢڢ٢ޢܢ�
��6�����ε��ᴿʵ����ÿ�������Լ��������������жϳ��ӹ���������BaCl2��Һ�Ƿ������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ����ȷ����
A. ���������ƺ��������ƻ����Һ��ͨ�������̼
B. ������������Һ�ζ���Ũ�ȵ�����ʹ���
C. ������������Һ��ͨ�������̼
D. �Ȼ���������Ļ������ͨ������������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni��Cd���ɳ�������ִ��������й㷺Ӧ�á���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
Cd(OH)2 + 2Ni(OH)2���йظõ�ص�˵����ȷ����
A�����ʱ������Ӧ��Ni(OH)2 ��e�� + OH- = NiOOH + H2O
B���������ǻ�ѧ��ת��Ϊ���ܵĹ���
C���ŵ�ʱ����������Һ�ļ��Բ���
D���ŵ�ʱ�������Һ�е�OH-�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A. BaSO3��ϡHNO3��Ӧ��BaSO3+2H+=Ba2��+SO2��+H2O
B. �ô�����Һ�ܽⱽ�ӣ�CO32-��2C6H5OH=2C6H5O����CO2����H2O
C. ����������ʵ���Ũ�ȵ�NH4Fe(SO4)2��Ba(OH)2��ϣ�2Fe3����3SO42-��3Ba2����6OH��=3BaSO4����2Fe(OH)3��
D. ��ʯī���缫���MgCl2��Һ��2Cl����2H2O![]() Cl2����H2����2OH��
Cl2����H2����2OH��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com