
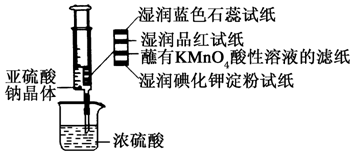
 如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润的蓝色石蕊试纸先变红后褪色 | |
| B. | 湿润的品红试纸,蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2的漂白性 | |
| C. | 湿润的碘化钾淀粉试纸未变蓝说明SO2氧化性强于I2 | |
| D. | 实验后,可把注射器中的物质推入NaOH溶液,以减少环境污染 |
分析 浓硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫为酸性氧化物与水反应生成亚硫酸,具有酸性,能够与氢氧化钠反应生成亚硫酸钠和水;二氧化硫具有强的还原性能够被酸性的高锰酸钾、卤素单质氧化,二氧化硫具有漂白性,能够使品红褪色,但是不能漂白指示剂.
A.SO2只能使酸碱指示剂变色,不能漂白指示剂;
B.SO2具有漂白性,能使品红试纸褪色,SO2具有还原性,与具有强氧化性的KMnO4发生氧化还原反应;
C.根据氧化剂+还原剂→氧化产物+还原产物,氧化性:氧化剂>还原剂分析;
D.SO2为酸性气体,可与NaOH溶液反应生成盐和水.
解答 解:A.SO2只能使酸碱指示剂变色,所以湿润的蓝色石蕊试纸只变红,故A错误;
B.品红试纸褪色,表现出SO2的漂白性,沾有KMnO4溶液的滤纸褪色,表现出SO2的还原性,故B错误;
C.湿润淀粉KI试纸变蓝,说明SO2能将KI氧化为I2,则SO2的氧化性强于I2,湿润的碘化钾淀粉试纸未变蓝,说明SO2氧化性弱于I2,故C错误;
D.SO2为酸性气体,有毒,可与NaOH溶液反应生成盐和水,所以NaOH溶液可用于除去实验中多余的SO2,故D正确.
故选D.
点评 本题考查二氧化硫的制备和性质,题目难度不大,注意SO2能使品红溶液褪色、KMnO4褪色的原因不同.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:10 | B. | 2:1 | C. | 105:1 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、Cl-、OH- | B. | Fe2+、Mg2+、SO42-、Cl- | ||
| C. | K+、Na+、CO32-、OH- | D. | Na+、Ba2+、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L | B. | 1.5mol/L | C. | 1mol/L | D. | 0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

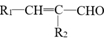 +H2O
+H2O +R2-OH$\stackrel{一定条件}{→}$
+R2-OH$\stackrel{一定条件}{→}$ +HCl
+HCl .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸光照变黄,证明硝酸不稳定,且产物有红棕色气体可溶于浓硝酸 | |
| B. | 向某溶液中加入氯化钡溶液和稀硝酸,生成白色沉淀,则原溶液一定含有硫酸根 | |
| C. | 常温下,将铝片放入浓硫酸中无明显现象,说明铝不与浓硫酸反应 | |
| D. | 溴水中通入SO2后,颜色褪去,说明SO2表现了漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑧ | B. | ③⑥⑨⑩ | C. | ④⑤⑥⑧ | D. | ④⑤⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
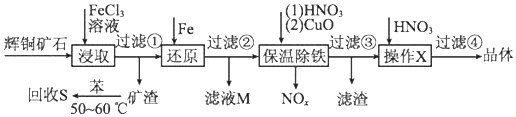
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com