
| A. | ①②③④ | B. | ②③④① | C. | ④③②① | D. | ②③①④ |
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:解答题

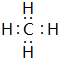 .
. .
.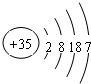 ,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.
,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 转变为的
转变为的 操作是( )
操作是( )| A. | 先与NaOH溶液共热,再通人足量C02 | B. | 先与NaOH溶液共热,冉通人足量HC1 | ||
| C. | 先与稀H2S04共热,加人足量Na2CO3 | D. | 先与稀H2S04共热,加人足量NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
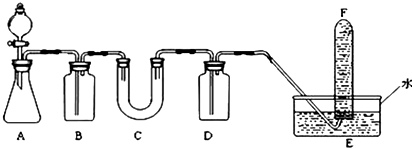
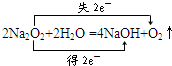 ,所以
,所以查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 增加CO,CO的平衡转化率增大 | |
| D. | 若平衡浓度符合关系$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时的温度为1000℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| C. | 一学生用广泛pH试纸测得某浓度的稀盐酸pH为2.3 | |
| D. | 配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融电解质中,O2-由正极移向负极 | |
| B. | 电解一共生成0.9 mol气体时,理论上消耗0.1 mol丁烷 | |
| C. | 电解池的阳极反应式为4OH--4e-═2H2O+O2↑ | |
| D. | 通入空气的一极是正极,电极反应式为O2+4e-═2O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中含有的化学键数为7NA | |
| B. | 1mol氯气和足量NaOH溶液反应转移电子数为2NA | |
| C. | 1mol OH- 和1 mol-OH(羟基)中含有的质子数均为9NA | |
| D. | 10L 0.1 mol•L-1 的Na2CO3溶液中,Na+、CO32- 总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com