
碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)=I3-。已知在不同温度下该反应的平衡常数如右图,下列说法不正确的是( )

A.上述反应正反应为放热反应
B.实验室配制碘水,为增大碘的溶解度可加入少量的KI
C.用该反应原理可除去硫粉中少量的碘单质
D.上述体系中加入苯,平衡不移动
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
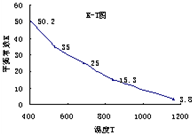 (2009?茂名二模)碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)=I3-.已知在不同温度下该反应的平衡常数如图,下列说法不正确的是( )
(2009?茂名二模)碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)=I3-.已知在不同温度下该反应的平衡常数如图,下列说法不正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)=I3-。已知在不同温度下该反应的平衡常数如右图,下列说法不正确的是( )

A.上述反应正反应为放热反应
B.实验室配制碘水,为增大碘的溶解度可加入少量的KI
C.用该反应原理可除去硫粉中少量的碘单质
D.上述体系中加入苯,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)=I3-。已知在不同温度下该反应的平衡常数如右图,下列说法不正确的是( )
A.上述反应正反应为放热反应
B.实验室配制碘水,为增大碘的溶解度可加入少量的KI
C.用该反应原理可除去硫粉中少量的碘单质
D.上述体系中加入苯,平衡不移动
查看答案和解析>>
科目:高中化学 来源:2012年鲁科版高中化学选修6 1.2 植物中某些成分的提取练习卷(解析版) 题型:选择题
碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I-(aq)===I3- (aq)。已知在不同温度下该反应的平衡常数如图:
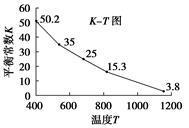
下列说法不正确的是( )
A.上述反应正反应为放热反应
B.实验室配制碘水,为增大碘的溶解度可加入KI
C.用该反应原理可除去硫粉中少量的碘单质
D.上述体系中加入苯,平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com