
���� ��1������N=nNA=$\frac{m}{M}$��NA��֪�����Ħ������Խ���еķ�����ԽС������V=$\frac{m}{M}$��Vm��֪��Ħ������ԽС���������Խ�ݴ˽��н��
��2���ȸ���n=$\frac{m}{M}$�����73.0g�Ȼ�������ʵ�����Ȼ�����N=nNA�ֱ��������еķ�������ԭ����������������������������V=nVm�������״����HCl�������
��3������MCl2�е�Cl-����Ŀ��������ʵ�����Ȼ�������M2+�����ʵ�������MCl2�����ʵ�����������M=$\frac{m}{n}$���MCl2��Ħ������������Ħ����������g/molΪ��λʱ����ֵ�ϵ�����Է����������MCl2����Է�������������������M�����ԭ��������
��4��0.5L 1mol/L FeCl3��Һ�������ӵ�Ũ��Ϊ3mol/L������ϡ�Ͷ��ɣ�ϡ��ǰ�������ӵ����ʵ������䣬�ݴ˼���ϡ�ͺ�������Һ�������ӵ�Ũ�ȣ�
��� �⣺��1��������ͬ��H2��NH3��SO2��O3���������У�N=nNA=$\frac{m}{M}$��NA��֪��������ͬʱ�����������Ħ�������ɷ��ȣ�Ħ������Խ���еķ�����ԽС�����Ժ��з��������ٵ���Ħ����������ΪSO2��
��V=$\frac{m}{M}$��Vm��֪��������ͬʱ�����������Ħ�������ɷ��ȣ��������������Ħ��������С�ģ�����������ΪH2��
�ʴ�Ϊ��SO2�� H2��
��2��73.0g HCl��������ʵ���Ϊ��n��HCl��=$\frac{73.0g}{36.5g/mol}$=2mol��2molHCl�к���2NA��HCl���ӣ�����ԭ����Ϊ��2NA��2=4NA������������Ϊ��2NA��18=36NA�����е�����Ϊ��2NA��18=36NA��
��״����2molHCl�����Ϊ��22.4L/mol��2mol=44.8L��
�ʴ�Ϊ��2NA��4NA��36NA��36NA��44.8��
��3����MCl2�к���3.01��1023��Cl-����Cl-�����ʵ���Ϊ$\frac{3.01��1{0}^{23}}{6.02��1{0}^{23}mo{l}^{-1}}$=0.5mol����M2+�����ʵ���0.25mol����MCl2�����ʵ���Ϊ0.25mol��MCl2��Ħ������M=$\frac{m}{n}$=$\frac{23.75g}{0.25mol}$=95g/mol��
��MCl2��Ħ������Ϊ95g/mol��������Է�������Ϊ95������M�����ԭ������Ϊ95-35.5��2=24��
�ʴ�Ϊ��95g/mol��95��24��
��4��0.5L 1mol/L FeCl3��Һ�������ӵ�Ũ��Ϊ3mol/L������ϡ�Ͷ��ɣ�ϡ��ǰ�������ӵ����ʵ������䣬��ϡ�ͺ�������Һ�������ӵ�Ũ��Ϊc����0.5L��3mol/L=1L��c�����c=1.5mol/L���ʴ�Ϊ��1.5mol/L��
���� ���⿼�������ʵ����ļ��㣬��Ŀ�ѶȲ�����ȷ���ʵ�����Ħ������������٤������������Ħ�����֮��Ĺ�ϵΪ���ؼ����������������ѧ���ķ�����������ѧ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��2 | B�� | 1��3 | C�� | 3��2 | D�� | 1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�1.7g NH3�����ĵ�����Ϊ0.8NA | |
| B�� | ��״���£�11.2L SO2��������ԭ����Ϊ1.5NA | |
| C�� | 1mol Fe��������ϡ���ᷴӦ��ת�Ƶĵ�������Ϊ3NA | |
| D�� | 0.1mol•L-1��Na2CO3��Һ�к��е���������Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 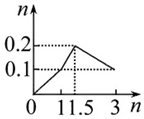 ��1 LŨ�Ⱦ�Ϊ0.1 mol•L-1��Ba��OH��2��NaAlO2���Һ�м���0.1 mol•L-1ϡ���� | |
| B�� |  ��1 L����0.1 mol•L-1 AlCl3��0.3 mol•L-1 NH4Cl�Ļ��Һ�м���0.1 mol•L-1 NaOH��Һ | |
| C�� |  ���ռ���Һ�μ�������Һ | |
| D�� | 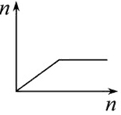 ��AlCl3��Һ�μӹ�����ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | w=$\frac{36.5a}{��36.5a+22400��}$ | B�� | w=$\frac{36.5c}{1000b}$ | ||
| C�� | C=$\frac{1000ab}{��36.5a+22400��}$ | D�� | b=$\frac{��36.5a+22400��}{��a+1��}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
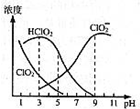 ����������һ�ָ�Ч������Ư������Ҫ�����ġ����顢ֽ����Ư�ף��������ƣ�NaClO2������Һ�п�����ClO2��HClO2��ClO2-��Cl-�ȣ�����HClO2��ClO2������Ư�����ã���ClO2���ж����壮���ⶨ��25��ʱ����ֺ�����pH�仯�����ͼ��ʾ��Cl-û�л������������з�����ȷ���ǣ�������
����������һ�ָ�Ч������Ư������Ҫ�����ġ����顢ֽ����Ư�ף��������ƣ�NaClO2������Һ�п�����ClO2��HClO2��ClO2-��Cl-�ȣ�����HClO2��ClO2������Ư�����ã���ClO2���ж����壮���ⶨ��25��ʱ����ֺ�����pH�仯�����ͼ��ʾ��Cl-û�л������������з�����ȷ���ǣ�������| A�� | ���������ڼ��������½��ȶ� | |
| B�� | ����Ч�Ⱥ�������������������������������������ָÿ�˺��������������������൱�ڶ��ٿ�Cl2��������������NaClO2����Ч�Ⱥ���ԼΪ1.57 | |
| C�� | pHԽ��Ư����Ư������Խ�� | |
| D�� | 25�棬pH=3ʱ��NaClO2��Һ�У�c��Na+��+c��H+��=c��ClO2-��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com