
| A. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP(AgCl)<KSP(AgBr) | |
| B. | 将0.001mol•L-1 AgNO3溶液滴入0.001mol•L-1 KCl和0.001mol•L-1 K2CrO4混合溶液中,先产生Ag2CrO4沉淀 | |
| C. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 | |
| D. | 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂为K2S |
分析 A.溶度积越小,则溶解度越小,越容易生成沉淀;
B.根据Ksp(AgCl)、Ksp(Ag2CrO4)计算出Cl-、CrO42-开始沉淀时c(Ag+)的大小,需要的c(Ag+)越小,优先生成沉淀;
C.银离子与氨水生成氢氧化二氨合银;
D.测定水体中氯化物的含量,必须使氯离子完全生成白色沉淀,指示沉淀反应完全的试剂溶解性一定小于氯化银,应在Ag+和Cl-生成AgCl沉淀后,再生成不同颜色沉淀指示沉淀终点,则指示剂的溶解度应比AgCl大来分析判断.
解答 解:A.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明AgBr比AgCl更难溶,则KSP(AgCl)>KSP(AgBr),故A错误;
B.Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,则生成沉淀时银离子浓度为:c(Ag+)=$\frac{1.8×1{0}^{-10}}{0.001}$mol/L=1.8×10-7mol/L,Ksp(Ag2CrO4)=c2(Ag+)c(CrO4 2-)=1.9×10-12,则生成沉淀时银离子浓度为:c(Ag+)=$\sqrt{\frac{1.9×1{0}^{-12}}{0.001}}$mol/L=4.36×10-5mol/L,生成氯化银需要的银离子浓度小,所以先析出AgCl,故B错误;
C.向AgCl的悬浊液中滴加浓氨水,银离子与氨水生成氢氧化二氨合银,沉淀溶解,使平衡向右移动,故C正确;
D.硫化银的Ksp很小,Ksp=[Ag+]2[S2-]=2.0×10-48,计算得到需要的阴离子浓度c(S2-)=$\root{3}{\frac{2×1{0}^{-48}}{2}}$=10×10-16;Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10,c(Cl-)=$\sqrt{1.8×1{0}^{-10}}$mol/L=1.34×10-5mol/L,根据计算可知硫化银比氯化银先沉淀,所以不能用硫化钾作指示剂,故D错误;
故选C.
点评 本题考查了难溶物溶解平衡的影响及计算,题目难度中等,明确难溶物溶度积的概念及表达式为解答关键,注意掌握难溶物溶解度与溶度积的关系,试题培养了学生的分析能力及化学计算能力.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | HCO3-的电离方程式:HCO3-+H2O═H2CO3+OH- | |
| D. | Cl2与H2O反应:Cl2+H2O═H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液变红 | |
| B. | Na2O与Na2O2组成元素相同、阴阳离子个数比相同,但跟水反应的产物不同 | |
| C. | 只存在共价键的物质一定是共价化台物、离子化合物中一定含有离子键 | |
| D. | 元素原子的最外层电子数越多,得电子能力越强,失电子能力越弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
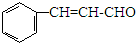
| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 溴的CCl4溶液 | D. | 银氨溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(A)=0.15mol/(l•s) | B. | V(B)=0.6mol/(l•s) | C. | V(C)=0.45mol/(l•s) | D. | V(D)=4.0mol/(l•min) |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
氧化还原反应与生产、生活、科技密切相关,请回答下列问题:

(1)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于__________腐蚀
(2)如图1所示的原电池装置中,负极的电极反应为_________________;H+的移动方向为_____________电池总反应方程式为_________________当电路中转移0.1mole-时,交换膜左侧溶液中减少的质量为_____________.
(3)电解NO制备NH4NO3原理如图2所示,接电源正极的电极为___________(填X或Y),X电极反应式为_____________为使电解产物完全转化为NH4NO3,需要补充的物质A的化学式为_______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com