
下列说法中,正确的是 ( )
| A.室温下,pH=5.6的NaHSO3溶液中c( SO32-)-c( H2SO3)= 10-5.6-10-8.4 |
| B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| C.吸热反应只有在加热条件下才能发生,故水不加热不电离 |
| D.过量的氨水和盐酸反应所得溶液不可能为酸性,但可能为中性 |
A
解析试题分析:A、在pH=5.6的亚硫酸氢钠中溶液中,依据电荷守恒和物料守恒可知,c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-)、c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),则c(H2SO3)+c(H+)=c(OH-)+c(SO32-),所以c( SO32-)-c( H2SO3)=c(H+)-c(OH-)=10-5.6-10-8.4,A正确;B、反应热与反应条件没有关系,只与反应物和生成物总能量的相对大小有关系,B不正确;C、吸热反应不一定非在加热条件下才能进行,同样不加热,水也可以电离,C不正确;D、只要溶液中c(H+)>c(OH-),溶液就显酸性,所以过量的氨水和盐酸反应所得溶液也可能显酸性,D不正确,答案选A。
考点:考查溶液中离子浓度大小比较、反应热、水的电离以及溶液酸碱性的判断等


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:单选题
半导体工业用石英砂做原料通过三个重要反应生产单质硅
SiO2(s)+2C(s)=Si(s)+2CO(g) △H1=+682.44kJ·mol-1
(石英砂) (粗硅)
Si(s)+2C12(g)=SiCl4(l) △H2=一657.01kJ·mol-1
(粗硅)
SiCl4(l)+2Mg(s)=2MgCl2(s)+Si(s) △H3=一625.63kJ·mol-1
(纯硅)
若生产1.00kg纯硅放出的热量为
| A.21.44kJ | B.600.20kJ | C.21435.71kJ | D.1965.10kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如下图所示,E1表示反应A+B→X的活化能。 下列有关叙述正确的是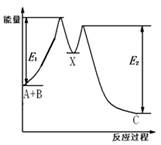
| A.E2表示反应X→C的活化能 |
| B.反应A+B→C的△H<0 |
| C.X是反应A+B→C的催化剂 |
| D.加入催化剂可改变反应A+B→C的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学家认为石油、煤作为能源使用时,燃烧了“未来的原始材料”。下列对上述观点理解正确的是
| A.大力提倡使用廉价化石燃料作为能源 |
| B.应更多地利用石油和煤生产基本化工原料 |
| C.化石燃料属于可再生能源,不影响可持续发展 |
| D.研发新型催化剂,提高石油和煤中各组分的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知反应A+B= C+D的能量变化如下图所示,下列说法正确的是
| A.该反应是放热反应 |
| B.只有在加热条件下才能进行 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如下图所示,下列结论不正确的是 ( )
| A.反应开始2 min内平均反应速率最大 |
| B.反应速率先增大后又减小 |
| C.反应开始4 min内温度对反应速率的影响比浓度大 |
| D.反应在第2 min到第4 min间生成CO2的平均反应速率为 v (CO2)="0.1" mol·min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于判断过程的方向的说法正确的是( )
| A.所有自发进行的化学反应都是放热反应 |
| B.高温高压下可以使石墨转化为金刚石是自发的化学反应 |
| C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 |
| D.同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
碘与氢气反应的热化学方程式是
①I2(g) + H2(g)  2HI(g) ΔH =-9.48 kJ·mol-1
2HI(g) ΔH =-9.48 kJ·mol-1
②I2(s) + H2(g)  2HI(g) ΔH =" +26.48" kJ·mol-1
2HI(g) ΔH =" +26.48" kJ·mol-1
下列说法正确的是( )
| A.①的产物比②的产物稳定 |
| B.I2(s) = I2(g) ΔH=" +17.00" kJ·mol-1 |
| C.②的反应物总能量比①的反应物总能量低 |
| D.1mol I2(g)中通入1 mol H2(g),发生反应时放热9.48 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(共12分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为 。
②又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H=—24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=—47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com