
| A. | 2种 | B. | 7种 | C. | 10种 | D. | 12种 |
分析 分子式为C4H8O2的有机物能发生银镜反应,说明含有醛基,可以是羟基醛,醚醛或甲酸丙酯来解答.
解答 解:分子式为C4H8O2的有机物能发生银镜反应,说明含有醛基,可以是羟基醛:OHCCH(OH)CH2CH3,OHCCH2CH(OH)CH3,OHCCH2CH2CH2(OH)
,CH3CH(CHO)CH2OH,CH3(HO)C(CHO)CH3,可以是醚醛:OHCCH2OCH2CH3,OHCCH2CH2OCH3,CH3OOCH(CHO)CH3,
可以是甲酸丙酯:HCOOCH2CH2CH3,HCOOCH(CH3)2,
所以共有10种同分异构体,故选C.
点评 本题主要考查同分异构体书写、官能团的性质与确定等,难度中等.


科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇燃烧 | B. | 乙烯使溴的四氯化碳溶液褪色 | ||
| C. | 甲烷和氯气混合,见光 | D. | 用乙醇、乙酸与浓H2SO4混合加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8只表示一种物质的分子组成 | |
| B. | C2H6的一氯代物只有1种 | |
| C. | C3H8O能与钠反应放出H2的同分异构体有3种 | |
| D. | 丙烷的二氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
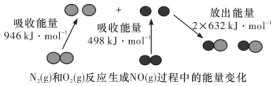 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 在1 L的容器中发生反应,10 min内 N2 减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol/(L•min) | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{Vd}{MN+2240}$ | B. | $\frac{1000Vd}{MN-2240}$ | C. | $\frac{1000VdM}{MN+2240}$ | D. | $\frac{MN}{22.4(V+0.1)d}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
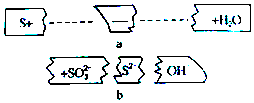
| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 该反应可能在酸性条件下进行 | |
| C. | 反应物微粒是S、SO32-、OH- | |
| D. | .2molS参加反应时,转移的电子数为$\frac{8}{3}$ NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
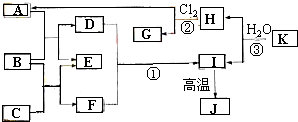 图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).
图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).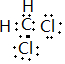 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com