
【题目】实验室现有一瓶标签右半部分已被腐蚀的固体M,剩余部分只看到“Na2S”字样(如图所示)。已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。若取少量固体M配成稀溶液进行下列有关实验,其中说法正确的是( )

A. 往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3
B. 往溶液中加入稀盐酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4
C. 用pH试纸检验,若pH=7,则固体M不一定是Na2SO4
D. 只用盐酸一种试剂不能确定该固体M的具体成分
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。下列说法正确的是
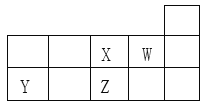
A. Y、Z、X三种元素的原子半径依次增大
B. X、Z都是第2周期VIA族元素,单质的氧化性X>Z
C. Y的气态氢化物的热稳定性比Z的高
D. R元素与W同族且相邻周期,则R元素最高价氧化物的水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,用煮沸过的蒸馏水溶解14gKOH配成250mL溶液,取出50mL溶液与CO2恰好完全反应(溶液体积变化忽略不计)。
(1)取出的50mLKOH溶液的pH=___________。
(2)若反应后溶液中c(CO32-)=c(HCO3-),则溶液中c(HCO3-)=_______mol·L-1(H2CO3忽略不计,计算结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力与加水量的关系。回答下列问题:

(1)0”点导电能力为0的理由__________________________________;
(2)a、b、c三点溶液中氢离子浓度由小到大的顺序为________________________;
(3)a、b、c三点中,醋酸的电离程度最大的一点是_____________;
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________;
A.加热 B.加水 C.加CH3COONa固体 D.加很稀的NaOH溶液
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是____________。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“三酸两碱”是最重要的无机化工产品,广泛用于化学、国防、石油、纺织、冶金、食品等工业。“三酸”是指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。回答下列问题:
(1)浓硝酸不稳定,易分解,需要保存在棕色细口瓶,并用________(填“玻璃”或“橡胶”)塞盖好,该分解的化学方程式为_______________________。
(2)将红热的木炭投入热的浓硝酸中,看到的现象是______________________。写出该反应的化学方程式______________________________。
(3)写出氨水与稀盐酸反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3: 物质结构与性质】
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
① Ti的基态原子价电子排布式为 。
② Fe的基态原子共有 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3 CCl4==="2" KCl+2 CrO2Cl2+3 COCl2↑。
① 上述化学方程式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
② COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 ,中心原子的杂化方式为 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为 。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是 cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图:
回答下列问题:
(1)从反应开始到10s时,用Z表示的反应速率为_______, X的物质的量浓度减少了___________,Y的转化率为______________。
(2)该反应的化学方程式为_________________________。
(3) 10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是______________。
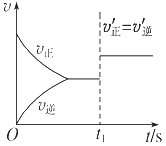
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3 g纯净的金属钠在干燥的空气中,被氧化后得到3.5 g固体,由此可判断出产物是
A. 氧化钠 B. 过氧化钠
C. 氧化钠和过氧化钠的混合物 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KHCO3溶液跟30.0g质量分数为24.0%的KHCO3溶液混合,得到密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数__________。
(2)混合后溶液的物质的量浓度________。
(3)在1000g水中需溶解___________摩尔KHCO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com