
下列操作中正确的是
A.用蒸发方法使NaCl从溶液中析出时,将蒸发皿中NaCl 溶液全部加热蒸干
B.在托盘天平上称量NaOH时,应将NaOH固体放在小烧杯中称量
C.用25 mL量筒量取4.0 mol/L的盐酸5.62 mL
D.用托盘天平准确称取5.85 g NaCl固体
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a
和 b 附近分别滴加一滴石蕊溶液。下列实验现象中错误的是
A.a电极附近呈红色,b电极附近呈蓝色
B.a电极附近呈蓝色,b电极附近呈红色
C.逸出气体的体积,a电极的大于b电极的
D.a、b两电极都逸出无色无味气体

查看答案和解析>>
科目:高中化学 来源: 题型:
铜单质及其化合物在工业生产和科研中有重要作用。
(1)已知:2Cu2O(s) + O2(g) === 4CuO(s) △H=-292kJ·mol-1
2C(s)+O2(g) ===2CO(g) △H=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式:
;
(2)现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯:
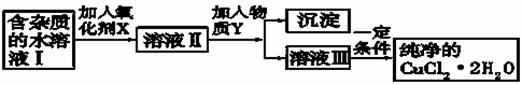
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
| 金属离子 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
①现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么?
;
该反应的离子方程式为 。
②溶液II中除Cu2+外,还有 金属离子,如何检验其存在 。
③物质Y不能为下列的
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
④若向溶液Ⅱ中加入碳酸钙,产生的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的操作和结论正确的是
A.将0.1 mol Na和少量 Al 片放入水溶液中,放出气体刚好是0.05 mol
B.Na2O2 投入到 FeCl2 溶液中只得到大量白色沉淀
C.镁粉中混有铝粉,可与NaOH溶液反应再过滤,得到镁粉
D.配制一定物质的量浓度溶液,定容时仰视容量瓶刻度线,使所得溶液浓度偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或描述中正确的是(填写字母)____ __
A.用托盘天平称取5.85g氯化钠固体
B.提取碘水中的碘单质时,可选用酒精作萃取剂
C.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
D.观察钾元素焰色反应的操作是:将铂丝在稀盐酸中洗涤后直接蘸取固体氯化钾,置于酒精灯火焰上进行灼烧,根据火焰是否显紫色来确定
E.氧化铁与足量盐酸反应后的溶液中滴加硫氰化钾溶液会生成血红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中正确的是( )
A、加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B、用酒精萃取碘水中的碘
C、称量NaOH 固体时,将NaOH 固体放在托盘天平左盘的纸上
D、用溶解、过滤的方法分离KNO3和NaCl的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列储存药品的方法中,正确的是
A.浓硫酸保存在橡胶塞试剂瓶中
B.浓硝酸保存在无色试剂瓶中
C.金属钠保存在煤油中
D.氢氧化钠溶液保存在玻璃塞试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
胆矾(CuSO4·5H2O)是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。

完成下列各题:
Ⅰ.(1)向含铜粉的稀硫酸中滴加浓硝酸,随着铜粉的溶解可能观察到的实验现象 ▲ 、 ▲ 。
(2)制得的胆矾晶体(CuSO4·5H2O)中可能存在的杂质是 ▲ (写化学式)。
(3)采用重量法测定CuSO4·5H2O的含量时,步骤如下:
①取样,称量 ②加水溶解 ③加氯化钡溶液生成沉淀 ④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是 ▲ 。
Ⅱ. 某研究性学习小组用ZRY-1型热重分析仪对12.5克硫酸铜晶体(CuSO4·5H2O)进行热重分析,随温度的升高,硫酸铜晶体依次发生下列反应。
a.CuSO4·5H2O CuSO4+5H2O
CuSO4+5H2O
b.CuSO4 CuO+SO3↑,2SO3
CuO+SO3↑,2SO3 2SO2+O2
2SO2+O2
c.4CuO 2Cu 2 O+O2↑
2Cu 2 O+O2↑
请回答下列问题:
(1)实验过程中热重分析仪测得残留固体质量为3.8 g,试推断该固体的组分是 ▲ (写化学式),其对应的物质的量之比是 ▲ 。
(2)热重分析仪加热晶体至恒重后,将全部气体导出,通入氢氧化钡溶液充分反应,所得沉淀经过滤、洗涤、干燥,质量为 ▲ g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com