
能正确表示下列反应的离子方程式是
A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓
C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O =HClO+ HSO3-
D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合:
2Al3++3SO +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
D
【解析】
,试题分析:A、硝酸具有强氧化性,与四氧化三铁反应时,亚铁离子被氧化为铁离子,错误;B、等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合时,氢离子与氢氧根离子液发生反应生成水,所以离子方程式为2H++Mg2++2OH-= Mg(OH)2↓+2H2O,错误;C、过量的二氧化硫与次氯酸钠发生氧化还原反应,生成氯离子、硫酸根离子、氢离子,错误;D、0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合,物质的量比是2:3,当氢氧根离子不足时,Al3+先与氢氧根离子结合,所以二者反应生成氢氧化铝和硫酸钡的沉淀,正确,答案选D。
考点:考查离子方程式的书写的判断


科目:高中化学 来源:2015届江西省高三第二次月考化学试卷(解析版) 题型:填空题
(10分) 测得某金属冶炼厂的酸性工业废水中,含有一定量的Fe3+、Cu2+、Au3+等离子。按照“变废为宝”的原则,设计了下图中的回收流程,要求利用常见的酸、碱和工业生产中的废铁屑,从该工业废水中回收金、并生产化工原料铁红和氧化铜。

请你完成下面的问题:
(1)流程图中标号处需加入的相应物质分别是:① ;② ;
③ ;④ ;⑤ 。
(2)写出流程图中①处可能发生的所有反应的离子方程式: 。
(3)写出流程图中③处发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:实验题
(14分)固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2 、 NO2 、 O2 乙:MgO 、 NO2 、 O2
丙:Mg3N2 、 O2 丁:MgO 、 NO2 、 N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是 。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明 。
②称取Mg(NO3)2固体3 .79 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是 ;关闭K,用酒精灯加热时,正确操作是先 ,然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想 是正确的。
②根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应: (填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是 。(用化学方程式表示)
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关物质分类或归类正确的是
①混合物:盐酸、氯水、水银 ②化合物:CaCl2、NaOH、HD
③电解质:胆矾、冰醋酸、氯化银 ④同素异形体:C60、金刚石、石墨
⑤放热反应:盐酸与氢氧化钠、碳与二氧化碳高温化合成一氧化碳、甲烷燃烧
A.①③ B.②③ C.③④ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为x mol
D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x)mol
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
欲使1L 0.5mol/L的NaOH溶液的浓度增大一倍,可采取的合理措施是
A.加入20g 固体NaOH,搅拌、溶解
B.将溶液加热浓缩至0.6 L
C.加入10mol/L的NaOH溶液0.1 L,再稀释至1.5 L
D.加入1 L 1.5 mol/L的NaOH溶液混合均匀
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三第一次模拟考试化学试卷(解析版) 题型:填空题
(12分)如图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的9/ 10,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
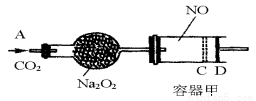
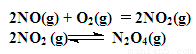
已知: 2Na2O2 + 2CO2 = 2Na2CO3 + O2
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g。
①此时,通入标准状况下的CO2气体 L ,容器甲中NO2转化为N2O4的转化率是
②活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必 0.01(填大于、小于、等于),其理由是
(2)若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于________g。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三第一次模拟考试化学试卷(解析版) 题型:选择题
下列表中所采取的分离方法与对应原理都正确的是 ( )
选项 | 目的 | 分离方法 | 原理 |
A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
C | 除去KNO3中混杂的NaCl | 重结晶 | 氯化钠在水中的溶解度很大 |
D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
查看答案和解析>>
科目:高中化学 来源:[同步]2015年同步(人教选修5)5-1合成高分子化合物的基本方法(解析版) 题型:选择题
人造象牙中,主要成分的结构是?CH2—O?,它是通过加聚反应制得的,则合成人造象牙的单体是( )
A.(CH3)2O B.HCHO
C.CH3CHO D.CH2OCH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com