
 ��ϩȩ���ṹ��ʽ��CH2=CHCHO����һ����Ҫ���л��ϳ�ԭ�ϣ����Ϊ��
��ϩȩ���ṹ��ʽ��CH2=CHCHO����һ����Ҫ���л��ϳ�ԭ�ϣ����Ϊ��

 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ��ͼװ��̽��NaHCO3�����ȶ��� |
B��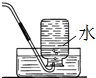 ��ͼװ��Cl2���ռ� |
C��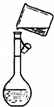 ��ͼװ��������ƿ��ת��Һ�� |
D�� ��ͼװ��ʯ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������AŨ�ȵ�˲�䣬V������V������ |
| B�������¶ȣ�V����С��V������ |
| C������ѹǿ��V������V����С |
| D�����������V����V�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(H+) |
| c(OH-) |
| c(H+) |
| c(H2C2O4) |
c(C2
| ||
c(HC2
|
c2(H+)?c(C2
| ||
| c(H2C2O4) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
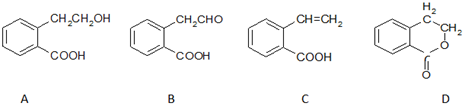
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.250 | 0.012 |
| ���� | �� | �� | �� | |
| ��Ӧ��Ͷ���� | 1molCO 2molH2 | 1molCH3OH | 2molCH3OH | |
| ƽ������ | CH3OH��Ũ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯�ľ���ֵ��kJ�� | a | b | c | |
| ��ϵѹǿ��Pa�� | P1 | P2 | P3 | |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����״����11.2 L���� |
| B��17g���� |
| C��0.8mol���� |
| D��4��ʱ��36mL��H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com