
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
分析 (1)结合平衡常数和平衡三行计算,CO反应速率v=$\frac{△c}{△t}$;
(2)反应①②平衡常数表达式计算得到反应③的平衡常数;
(3)分析图表反应②的平衡常数随温度升高而减小,说明平衡逆向进行,正反应是放热反应;反应②反应前后气体体积不变,压强、催化剂不能使平衡移动,可通过改变温度、浓度使平衡向正反应移动;
(4)达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的物理量不变;
(5)①由表中数据可知,温度越高平衡常数K1越大,所以平衡向正反应进行,升高温度平衡向吸热方向移动,即正反应为吸热反应,所以降低温度平衡向逆反应移动,据此解答;
②再通入CO2,等效为原平衡增大压强,反应前后气体体积不变,平衡不移动,转化率不变;
(6)反应①反应前后气体体积不变,正反应为吸热反应,据此分析判断.
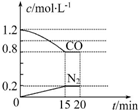
解答 解:(1)反应①Fe(s)+CO2(g)?FeO(s)+CO(g),500℃反应①的平衡常数为K1=1,根据平衡常数的表达式可知,平衡时CO2与CO的浓度相等,CO2起始浓度为1mol.L-1,根据C原子守恒,所以平衡时c(CO2)=c(CO)=$\frac{1}{2}$×1mol.L-1=0.5mol.L-1,
V(CO)=$\frac{0.5mol/L}{10min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(2)①Fe(s)+CO2(g)?FeO(s)+CO(g)平衡常数K1;反应②Fe(s)+H2O(g)?FeO+H2(g)平衡常数为K2,900℃进行反应③H2(g)+CO2(g)?H2O(g)+CO(g),其平衡常数K=$\frac{c(CO)c({H}_{2}O)}{c({H}_{2})c(C{O}_{2})}$=$\frac{{K}_{1}}{{K}_{2}}$=$\frac{2.4}{1.6}$=1.50;
故答案为:1.50;
(3)由(2)分析知反应②正反应为放热反应,且反应前后气体体积不变,图表反应②的平衡常数随温度升高而减小,说明平衡逆向进行,正反应是放热反应;反应②的焓变△H<0;
A、缩小反应器体积,增大压强,平衡不移动,故A错误;
B、加入水蒸气,反应物的浓度增加,平衡向正反应移动,故B正确;
C、该反应为放热反应,降低温度平衡向正反应进行,故C正确;
D、加入铁粉是固体对平衡无影响,平衡不移动.故D错误.
故答案为:BC;
(4)Fe(s)+CO2(g)═FeO(s)+CO(g),反应为气体体积不变的反应,
A.反应速率之比等于化学方程式计量数之比,v正(CO)=v 逆 (CO2)说明二氧化碳正逆反应速率相同,说明反应达到平衡状态,故A正确;
B.C(CO)=C(CO2)浓度相同,和起始量变化量有关,不能说明反应达到平衡状态,故B错误;
C.反应前后气体体积不变,气体质量变化,则容器内气体的密度不变能说明反应达到平衡状态,故C正确;
D.反应前后气体物质的量不变,容器内压强始终不变,不能说明反应达到平衡状态,故D错误;
故答案为:AC;
(5)①由表中数据可知,温度越高平衡常数K1越大,所以升高温度平衡向正反应进行,升高温度平衡向吸热方向移动,即正反应为吸热反应,所以降低温度平衡向逆反应移动,CO2的平衡浓度增大,
故答案为:增大;
②再通入CO2,等效为原平衡增大压强,反应前后气体体积不变,平衡不移动,转化率不变,
故答案为:不变;
(6)由表中数据可知,温度越高平衡常数K1越大,所以升高温度平衡向正反应进行,升高温度平衡向吸热方向移动,即正反应为吸热反应,且反应①反应前后气体体积不变.
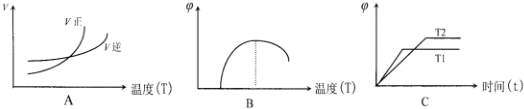
A、处于交点时,正逆速率相等,反应处于平衡状态,当温度高于交点温度,平衡向正反应移动,说明图象表示正反应为吸热反应,符合温度变化对反应①的影响,故A正确;
B、在最高点时,反应处于平衡状态,当温度高于最高点对应的温度,CO的含量降低,平衡向逆反应移动,说明图象表示正反应为放热反应,故B错误;
C、到达平衡时间越短,速率越快,温度越高,所以T1>T2,温度越高,CO的含量越低,平衡向逆反应移动,说明图象表示正反应为放热反应,故C错误.
故答案为:A
点评 本题考查化学平衡移动、平衡常数计算等问题,题目难度中等,图象分析判断.平衡移动原理的应用,掌握基础是关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “霾”是当今世界环境热点话题.某地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
“霾”是当今世界环境热点话题.某地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥ | B. | ④⑥ | C. | ②④⑦ | D. | ③④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
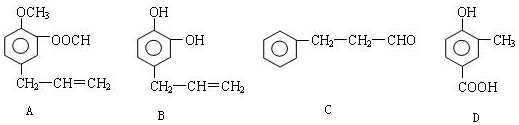
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
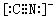 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com