
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:C6H12O6(葡萄糖)+Br2+H2O![]() C6H12O7(葡萄糖酸)+2HBr,2C6H12O7(葡萄糖酸)+CaCO3
C6H12O7(葡萄糖酸)+2HBr,2C6H12O7(葡萄糖酸)+CaCO3![]() Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑,相关物质的溶解性见下表:
Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑,相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
实验流程如下:
C6H12O6溶液![]()
![]()
![]()
![]() 悬浊液
悬浊液![]()
![]()
![]() Ca(C6H11O7)2
Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是________。

制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是____。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是__________________________;
本实验中不宜用CaCl2替代CaCO3,理由是__________________。
(3)第③步需趁热过滤,其原因是____________________________________。
(4)第④步加入乙醇的作用是__________________________________。
(5)第⑥步中,下列洗涤剂最合适的是___________________________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
【答案】 B C 提高葡萄糖酸的转化率 便于后续分离CaCl2难与葡萄糖酸直接反应得到葡萄糖酸钙 葡萄糖酸钙冷却后会结晶析出,如不趁热过滤会损失产品 可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出 D
【解析】葡萄糖溶液中加入3%溴水、温度控制在55℃,温度小于100℃,应该用水浴加热,且温度计测量水浴温度;发生的反应为CH2OH(CHOH)4CHO+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr,该反应中生成HBr,为防止污染大气,应该用碱液处理HBr;然后向溶液中加入过量CaCO3、温度控制在70℃,发生反应2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑,葡萄糖酸钙可溶于冷水易溶于热水,所以趁热过滤,将未溶解的碳酸钙除去,然后向滤液中加入乙醇,葡萄糖酸钙微溶于乙醇,所以得到葡萄糖酸钙悬浊液,然后抽滤得到固体,然后洗涤、干燥固体最后得到Ca(C6H11O7)2固体;
(1)由于实验中需要能够控制滴加溴和水浴加热,A不能控制添加溴,C没有进行水浴加热,故装置B最合适,由于葡萄糖是一种多羟基的醛,所以可以被弱氧化剂氧化成羧酸类,酸性高锰酸钾溶液可以氧化羟基,A、D会产生重金属杂质离子,通过醛类催化氧化是最合适的。
(2)第②步充分反应后CaCO3固体需有剩余,其目的是:提高葡萄糖酸的转化率,符合强酸制备弱酸原理,氯化钙难以与葡萄糖酸直接反应得到葡萄糖酸钙,不宜用CaCl2替代CaCO3。
(3)葡萄糖酸钙冷却后会结晶析出,如不趁热过滤会损失产品。
(4)葡萄糖酸钙在乙醇中的溶解度是微溶,第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(5)利用水可以将无机杂质溶解除掉,同时利用葡萄糖酸钙在乙醇中的微溶,减少葡萄糖酸钙的损失,第⑥步中,下列洗涤剂最合适的是D。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类(填写编号)。
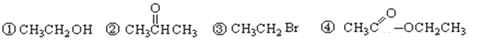

(1)芳香烃:__________;(2)卤代烃:__________;(3)醇:______________; (4)酚:______________;(5)醛:______________;(6)酮:______________;(7)羧酸:____________;(8)酯:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内有20多种微量元素,它们的质量总和不到体重的千万分之一,但是对人的健康却起着重要的作用,下列各组元素全部是微量元素的是( )
A. Na K Cl S O B. B Mn Fe Zn Cu
C. N H O P C D. Ge Ca Cu Mg C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
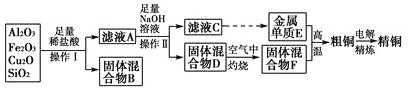
已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)操作Ⅰ的名称为________;灼烧操作中常用的实验仪器有酒精灯、三角架,还有________(夹持仪器不写)。
(2)固体混合物B的主要成分为______(写化学式);滤液A中铁元素的存在形式只能为 Fe2+,理由是________。检验滤液A中Fe2+的试剂为_______(填试剂名称)。
(3)滤液中C铝元素的主要存在形式为______(填离子符号),写出对应的离子方程式______。
(4)某同学认为滤液NaAIO2的水解程度是微弱的,AIO2-的水解不超过总量的10%,请设计实验验证该同学的观点是否正确_________。
(5)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,主要步骤:称取一定质量的样品→________________(填缺少的操作步骤,不必描述操作过程的细节)→过滤、洗涤、干燥→称量剩余固体铜的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
有机物F是有机合成工业中一种重要的中间体。以甲苯和丙烯为起始原料合成F的工艺流程如下:

回答下列问题:
(1)化合物B中含氧官能团名称是_________F的结构简式__________________
(2)写出C与银氨溶液共热的化学反应方程式:_______________________
(3)化合物D不能发生的反应有__________________(填序号)。
①加成反应②取代反应③消去反应④氧化反应⑤水解反应
(4)B的含苯环结构的同分异构体还有__________种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是____________(填结构简式)。
(5)B与D发生反应的类型________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式如右图,有关该化合物的叙述不正确的是( )
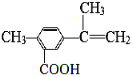
A. 该有机物的分子式为C11H12O2
B. 1mol该物质最多能与4molH2发生加成反应
C. 该有机物一定条件下,可以发生取代、氧化、聚合、酯化反应
D. 该有机物能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:
2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0
①该反应中,反应物总能量_____(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为__mol。
③该反应中,还原剂为______(填化学式),氧化产物与还原产物的质量比为______________。
(2)也可以利用甲烷催化还原氮氧化物.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是_________________。
(3)还可利用ClO2消除氮氧化物的污染,反应过程如下(部分反应物或生成物略去):![]()
反应I的产物中还有两种强酸生成,且其中一种强酸为硝酸,且硝酸与NO3物质的量相等,则化学反应方程式为______,反应中若生成22.4L N2(标准状况),则消耗ClO2______g。
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
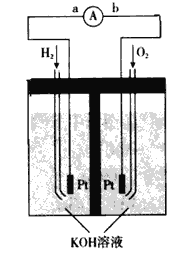
①氢氧燃料电池的能量转化主要形式是________,工作时电流方向为________(用a、b和箭头表示)。
②负极的电极反应式为__________________。
③电极表面镀铂粉的原因为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D四种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出D元素价电子的电子排布式:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 。
①[D(H2O)6](NO3)3中阴离子的立体构型是_____________。NO3-中心原子的轨道杂化类型为__________。
②在[D(H2O)6] 3+中D3+与H2O之间形成的化学键称为______,1 mol [D(H2O)6] 3+ 中含有的σ键有________mol。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中________(填化学式)为非极性分子。另一种物质的电子式为_____________。
(4)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的剖面图:
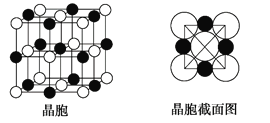
晶胞中距离一个A+最近的C-有________个,这些C-围成的图形是______________,若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则A+的离子半径为________cm(用含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转换的认识中不正确的是
A. 白炽灯工作时,电能全部转化为光能
B. 普通干电池工作时将化学能转变为电能
C. 化学反应中的能量变化,通常主要表现为热量的变化
D. 火力发电是通过化石燃料燃烧,使化学能经过一系列能量转化最终转变为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com