
已知:(1)Zn(s)+1/2O2(g)= Z nO(s), ΔH=-348.3kJ/mol
nO(s), ΔH=-348.3kJ/mol
(2)2Ag(s)+1/2 O2(g)= Ag2O(s), ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)= ZnO(s)+ 2Ag(s)的ΔH等于
2Ag(s)的ΔH等于
A. -317.3kJ/mol B. -379.3kJ/mol C. -332.8 kJ/mol D. +317.3 kJ/mo l
l
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末化学试卷(解析版) 题型:填空题
I.某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
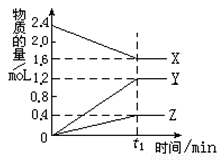
(1)该反应的化学方程式是______.
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则至t1min时,该反应吸收的热量为:______;在此t1min时间内,用H2表示反应的平均速率v(H2)=______。
II.亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:Na2SO3+KIO3+H2SO4═Na2SO4+K2SO4+I2+H2O,
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢) ②IO2-+SO32-→IO-+SO42-(快)
③5I-+6H++IO3-→3I2+3H2O(快) ④I2+SO32-+H2O→2I-+SO42-+2H2(快)
(1)根据上述条件推测,此反应的总的反应速率由第______步反应决定.
(2)若预先加入淀粉溶液,由题述看必在______离子消耗完时,才会有使淀粉变蓝的现象产生.
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三高考前模拟理综化学试卷(解析版) 题型:选择题
在容积一定的密闭容器中,置入一定量 的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)
的一氧化氮和足量碳发生化学反应:C(s)+2NO(g) CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是( )
CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是( )
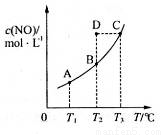
A. 在T2时,若反应体系处于状态D,则此时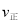
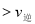
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB
D.该反应的△H>0
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市高三高考前最后一卷理综化学试卷(解析版) 题型:选择题
中国传统文化对人类文明贡献巨大,我国古代的人民在那时候就已经广泛应用了相关的化学知识,古化文献中充分记载了古代化学研究成果。下列关于古代化学的应用和记载,对其说明不合理的是
A.《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳机诸药者”,这是利用了“KNO3的氧化性”
B.李白有诗云“日照香炉生紫烟”,这是描写“碘的升华”
C.《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,这是利用了“焰色反应”。
D.我国古代人民常用明矾水除去铜器上的铜锈〔Cu2(OH)2CO3〕
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下第二次段考化学卷(解析版) 题型:选择题
在一定条件下,使NO和O2在一密闭容器中进行可逆反应,下列说法中不正确的是
A. 反应开始时,正反应速率最大,逆反应速率为零
B. 随着反应进行,正反应速率逐渐减小,最后为零
C. 随着反应进行,逆反应速率逐渐增大,最后不变
D. 随着反应的进行,正反应速率逐渐减小,最后不变
查看答案和解析>>
科目:高中化学 来源:2016届江苏省等三校高三第四次模拟化学试卷(解析版) 题型:填空题
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高.其主要流程如下:

注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
请回答下列问题:
(1)反应Ⅰ的产物为____________(填化学式).
(2)反应Ⅲ的离子方程式为____________;
(3)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其可能的原因是____________;
(4)反应Ⅳ在高温条件下进行,化学方程式是____________;
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol•L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL.已知:Cr2O72-+Fe2++H+→Cr3++Fe3++H2O(未配平)
①SO2通入Fe(SO4)3溶液中,发生反应的离子方程式为____________;
②反应Ⅳ所得气体中SO2的体积分数为____________。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月模拟四理综化学试卷(解析版) 题型:简答题
四川含有丰富的矿产资源,钒矿、硫铁矿、铜矿等七种矿产储量位居全国前列。回答下列问题:
(1)钒在元素周期表中的位置为 ,V3+的价电子排布图为 。
(2)钒的某种氧化物的晶胞结构如图1所示,其晶体的化学式为
(3)V2O5常用作SO2 转化为SO3的催化剂。SO2 分子中键角 120°(填“>”、“<”或“=”); SO3的三聚体环状结构如图2所示,该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个σ键。
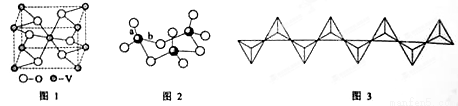
(4)V2O5 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ,例举与VO43-空间构型相同的一种阳离子和一种阴离子 (填化学式);也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 。
(5)硫能形成很多种含氧酸,如H2SO3、H2SO4。硫的某种含氧酸分子式为H2S2O7,属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,试写出其结构式 (配位键须注明)。
(6)利用铜萃取剂M,通过如下反应实现铜离子的富集:
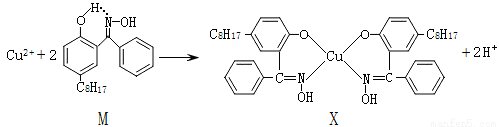
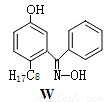
M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三高考打靶测试理综化学试卷(解析版) 题型:实验题
(14分)ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11℃,易溶于水,是常见的消毒剂。工业上常用二氧化硫还原氯酸钠(NaClO3)的方法制备ClO2,某学生拟用下图所示装置模拟工业制取并收集少量ClO2。

(1)下列制备气体所用装置与A装置相同的是_______________;
a.用过氧化氢与二氧化锰制氧气
b.用铜与浓硫酸制二氧化硫
c.用硫化亚铁与稀硫酸制硫化氢
d.只用浓氨水制氨气
(2)实验前,要检验装置的气密性,通常先___________________,将导气管插入盛有水的烧杯中,微热锥形瓶,若导管未端产生气泡,并在停止微热后,___________________,说明装置不漏气。
(3)二氧化硫与氯酸钠的反应需在75~90℃进行,为此,B装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、_________;写出B中产生二氧化氯的离子方程式_________________;
(4)C装置放在冰水浴中,其原因是_________________;
(5)用氢氧化钠溶液吸收ClO2,反应后可得到NaClO2与NaClO3混合液。
已知:NaClO2饱和溶液在较低温度时析出晶体NaClO2·3H2O,在较高温度时析出晶体 NaClO2;NaClO在高温时溶解度很大。
则从该混合溶液中获得晶体NaClO2的操作步骤为:①蒸发浓缩结晶;②_________;③洗涤干燥。
(6)碘量法可以检测水中ClO2的浓度,步骤如下:
①取1L水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝;(ClO2全部转化为NaClO2)
②用1.0×10-3 mol•L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液10.00mL;(已知:2S2O32-+I2═S4O62-+2I-)
确定操作②达到滴定终点的现象是_________________________________;
经计算,水样中ClO2的浓度是__________mg•L-1,若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____________;(填“偏高”、“偏低”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com