
工业合成氨的反应为N2(g)+3H2(g)⇌2NH3(g).设t℃在容积为2L的密闭容器中充入0.6mol N2和1.6mol H2,反应在一定条件下达到平衡时,NH3的物质的量分数为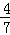 .计算:
.计算:
(1)达到平衡时H2的物质的量;
(2)t℃该反应的平衡常数.
| 化学平衡的计算. | |
| 专题: | 化学平衡专题. |
| 分析: | (1)先设氮气的转化率为x,利用三段式,计算平衡时生成氨气的物质的量、剩余氮气的物质的量和剩余氢气的物质的量,再结合氨气的质量分数计算氢气的物质的量; (2)根据平衡常数K= |
| 解答: | 解:(1)设氮气的转化率是x, N2 +3H2 起始量(mol) 0.6 1.6 0 变化量(mol) 0.6x 1.8x 1.2x 平衡量(mol)0.6(1﹣x) 1.6﹣1.8x 1.2x 平衡时,NH3的物质的量分数= x=66.7%,所以氢气的物质的量为1.6﹣1.8x=0.4 mol, 答:达到平衡时H2的物质的量为0.4mol; (2)平衡时氮气的物质的量浓度= 平衡常数K= 答:该条件下反应的平衡常数为200. |
| 点评: | 本题考查了有关化学平衡的计算,难度不大,注意计算化学平衡常数时各物质的浓度必须是平衡时的浓度. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
乙醇的沸点比含相同碳原子数的烷烃的沸点高的主要原因是( )
A.乙醇的分子量比含相同碳原子数的烷烃的分子量大
B.乙醇分子之间易形成氢键
C.碳原子与氢原子的结合程度没碳原子与氧原子的结合程度大
D.乙醇是液体,而乙烷是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中物质分类正确的是( )
| 编号 | A | B | C | D |
| 强电解质 | H2SO4 | KNO3 | BaSO4 | HClO4 |
| 弱电解质 | CaCO3 | HF | HClO | 氨水 |
| 非电解质 | NH3 | SO2 | H2O | C2H5OH |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 在高温下,将氯化铵晶体加入处于平衡状态的合成氨反应时,平衡不发生移动 |
|
| B. | 在密闭容器中,当CaCO3(s)⇌CaO(s)+CO2(g)处于平衡状态时,再加入Na2O2固体CaCO3的量会减少 |
|
| C. | 有固体参加的可逆反应达平衡后,若改变压强,不会影响平衡的移动 |
|
| D. | 在合成氨反应中,使用催化剂能提高反应速率,使氨的质量分数增加,从而增加氨的产量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
T℃,向5L恒容密闭容器中充入1molSO3气体,发生反应2SO3(g)⇌2SO2(g)+O2(g)
△H=+196kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量.当温度度不变时,改变某一条件,下列结论正确的是( )
| 条件改变 | 结论 | |
| A | 平衡后向容器中充入1molHe | 平衡常数不变,混合气体的密度也不变 |
| B | 起始时向容器中充入0.5molSO2、0.25molO2和2molSO3 | 反应达到平衡前v(正)>v(逆) |
| C | 起始时向容器中充入1molSO2和0.5mol O2 | 达到平衡时共放出78.4kJ的热量 |
| D | 起始时向容器中充入1molSO2和0.5molO2 | 达到平衡时,SO2的转化率为60% |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
利用海水制备部分物质的流程图如下。下列有关说法正确的是

A.电解熔融氯化镁制备镁,副产物氯气可以用于制盐酸,循环利用
B.联合制碱法最终副产物为氯化铵,原子利用率小于100%
C.步骤②的操作是:在空气中加热氯化镁晶体得到无水氯化镁
D.海水中离子的浓度较小,上述流程图只涉及溴元素的富集过程
查看答案和解析>>
科目:高中化学 来源: 题型:
据新浪网报道,欧洲一集团公司拟在太空建立巨大的激光装置,把太阳光变成激光用于分解海水制氢.有下列几种说法:
①水分解反应是放热反应;
②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;
③使用氢气作燃料有助于控制温室效应;
④氢气是一级能源.
其中叙述正确的是( )
|
| A. | ①② | B. | ③④ | C. | ②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:HCN(aq)+NaOH(aq)═NaCN(aq)+H2O(l)△H=﹣12.1kJ•mol﹣1;
HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=﹣55.6kJ•mol﹣1
则HCN在水溶液中电离的△H等于( )
|
| A. | +43.5 kJ•mol﹣1 | B. | +67.7 kJ•mol﹣1 |
|
| C. | ﹣43.5 kJ•mol﹣1 | D. | ﹣67.7 kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于价层电子对互斥模型(VSEPR模型)的叙述中不正确的是( )
A.VSEPR模型可用来预测分子的立体结构
B.分子中价电子对相互排斥决定了分子的空间结构
C.中心原子上的孤电子对不参与互相排斥
D.分子中键角越大,价电子对相互排斥力越小,分子越稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com