
在一定温度下向足量的饱和![]() 溶液中加入1.06g无水
溶液中加入1.06g无水![]() ,搅拌后静止,最终析出的晶体的质量( )
,搅拌后静止,最终析出的晶体的质量( )
A、等于1.06g B、大于1.06g而小于2 .86g
C、等于2.86g D、大于2.86g
科目:高中化学 来源: 题型:013
在一定温度下, 向足量的饱和Na2CO3溶液中加入1.06g无水Na2CO3, 搅伴后静置, 最终所得晶体的质量
[ ]
A. 1.06g B.>1.06g <2.86g C. 2.86g D. >2.86g
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
则N2(g)+3H2(g)=2NH3(g)的△H= 。
(2)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入固定体积为1L的密闭容器中达到平衡后,改变下列条件,能使平衡向正反应方向移动的是 。
①增大压强 ②通入He
③使用催化剂 ④降低温度
(3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
![]() 。计算该条件下达到平衡时N2转化率为 ;
。计算该条件下达到平衡时N2转化率为 ;
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验:(其中c、d均为碳棒,NaCl溶液的体积为500ml)
①b极为 极,电极反应式 ;
c极为 极,电极反应式
②右图装置中,当b极上消耗的O2在标准状况下的体积为280ml时,则乙池溶液的PH为 (假设反应前后溶液体积不变,且NaCl溶液足量)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年云南省高三1月月考(理综)化学部分 题型:填空题
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
则N2(g)+3H2(g)=2NH3(g)的△H= 。
(2)工业合成氨的反应为N2(g)+3H2(g)
 2NH3(g)。在一定温度下,将一定量的N2和H2通入固定体积为1L的密闭容器中达到平衡后,改变下列条件,能使平衡向正反应方向移动的是
。
2NH3(g)。在一定温度下,将一定量的N2和H2通入固定体积为1L的密闭容器中达到平衡后,改变下列条件,能使平衡向正反应方向移动的是
。
①增大压强 ②通入He
③使用催化剂 ④降低温度
(3)工业合成氨的反应为N2(g)+3H2(g)
 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为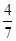 。计算该条件下达到平衡时N2转化率为
;
。计算该条件下达到平衡时N2转化率为
;
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验:(其中c、d均为碳棒,NaCl溶液的体积为500ml)

①b极为 极,电极反应式 ;
c极为 极,电极反应式
②右图装置中,当b极上消耗的O2在标准状况下的体积为280ml时,则乙池溶液的PH为 (假设反应前后溶液体积不变,且NaCl溶液足量)
查看答案和解析>>
科目:高中化学 来源: 题型:
A.等于1.06 g B.大于1.06 g而小于2.86 g
C.等于2.86 g D.大于2.86 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com