
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取21.82g食盐 | |
| B. | 用酸式滴定管量取15.30mL 0.10mol/L H2SO4溶液 | |
| C. | 用量筒量取13.56mL盐酸 | |
| D. | 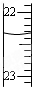 滴定达终点时,右图滴定管的正确读数为23.65mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol NO2 | B. | 0.3mol NO、0.1mol NO2 | ||
| C. | 0.6mol NO | D. | 0.3mol NO2、0.1mol NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
| 主要化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低价 | -2 | -3 | -1 | -3 | |||||
| A. | 元素④和⑦的最高价氧化物的水化物的化学式不一定都为HRO3 | |
| B. | 元素③和⑥的最高价氧化物的水化物中,只有⑥的最高价氧化物的水化物能与Al(OH)3反应 | |
| C. | 元素①与元素②形成的化合物中不可能存在共价键 | |
| D. | 元素⑤的简单离子的半径是同周期主族元素简单离子中最大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2NH3(g)△H=-92kJ•mol-1.
2NH3(g)△H=-92kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
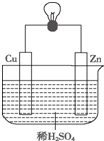 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,做了如下记录,其中描述合理的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,做了如下记录,其中描述合理的是( )| A. | ①②③ | B. | ③④⑥ | C. | ④⑤⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②④ | C. | ②③⑤ | D. | ③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com