
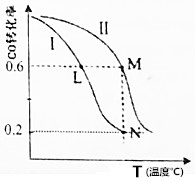
| A. | 该反应的△H>0 | |
| B. | M点化学平衡常数K=0.59 | |
| C. | L、M两点容器内压强:P(M)>2P(L) | |
| D. | 向N点平衡体系中再加入1molCH3OH,建立新平衡时被分解的CH3OH物质的量小于0.4mol |
分析 A、升高温度一氧化碳的转化率减小,说明平衡逆向移动,正反应是放热反应;
B、根据一氧化碳的转化率为0.6,结合三行式求各物质的平衡浓度,代入平衡常数表达式求解;
C、根据阿伏加德罗定,温度和体积一定压强与物质的量成正比,而M和L点的转化率相等;
D、N点平衡体系中CH3OH的物质的量为:0.2mol,再加入1molCH3OH,所以此时CH3OH的物质的量为:1.2mol,由B可知平衡时CH3OH的物质的量为1.2mol.
解答 解:A、升高温度一氧化碳的转化率减小,说明平衡逆向移动,正反应是放热反应,所以△H<0,故A错误;
B、CO(g)+2H2(g)?CH3OH(g)
初起(mol/L):1 2 0
变化(mol/L):0.6 1.2 0.6
平衡(mol/L):0.4 0.8 0.6
所以平衡常数为:$\frac{0.6}{0.4×0.{8}^{2}}$=2.34,故B错误;
C、Ⅰ中加入1molCO和2molH2,向Ⅱ中加入2molCO和4molH2,如果温度相同,压强P(M)=2P(L),而M点的温度高于L点,所以P(M)>2P(L),故C正确;
D、N点平衡体系中CH3OH的物质的量为:0.2mol,再加入1molCH3OH,所以此时CH3OH的物质的量为:1.2mol,由B可知平衡时CH3OH的物质的量为1.2mol,所以在此温度下平衡不移动,故D错误;
故选C.
点评 本题考查转化率随温度的变化图象,由明确图象中量的变化、转化率、影响平衡的移动因素等,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 室内着火被困,立即用湿毛巾堵住口鼻,匍匐前进,寻找安全出口 | |
| B. | 电石燃烧时,可以用常规的水枪灭火 | |
| C. | 误服食品袋中的干燥剂(生石灰),立即喝食醋 | |
| D. | 少量的浓硫酸沾到皮肤上,立即用大量的水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2HBr+Na2CO3═2NaBr+H2O+CO2↑ | B. | 2HBr+CaCO3═CaBr2+H2O+CO2↑ | ||
| C. | HBr+NaOH═NaBr+H2O | D. | 2HBr+2Ag═AgBr+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用加碘食盐以防止碘缺乏病 | |
| B. | 使用铁锅炒菜可以减少贫血病的发生 | |
| C. | 保持科学的饮食习惯,全面摄入各种微量元素 | |
| D. | 多吃各种营养品,以增大微量元素的吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中,若消耗7.1g Cl2,必转移0.2NA个电子 | |
| B. | 将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 | |
| C. | 12g NaHSO4在熔融时离子总数为0.3NA | |
| D. | 标准状况下,11.2L氦气所含的原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
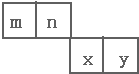 m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:
m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则: .
.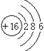 .
. ,此物质属于离子化合物.(填“离子”或“共价”)
,此物质属于离子化合物.(填“离子”或“共价”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com