
 .
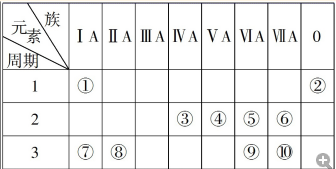
.分析 由元素在周期表的位置可知,①~⑩分别为H、He、C、N、O、F、Na、Mg、S、Cl,
(1)Cl的最高价为+7价,与④号元素同主族的相邻周期元素为P,P元素的最高价为+5价;
(2)①⑤⑦形成的化合物为NaOH;
(3)HF含氢键沸点较高;
(4)④和⑤分别形成的10电子微粒分别为氨气、水;
(5)上述元素中,Na的金属性最强,最高价氧化物对应水化物碱性最强;非金属性越强,对应阴离子的还原性越强.
解答 解:由元素在周期表的位置可知,①~⑩分别为H、He、C、N、O、F、Na、Mg、S、Cl,
(1)Cl的最高价为+7价,⑩号元素最高价氧化物对应水化物化学式为HClO4;与④号元素同主族的相邻周期元素为P,P元素的最高价为+5价,与最高价氧化物对应水化物的化学式为H3PO4,故答案为:HClO4;H3PO4;
(2)①⑤⑦形成的化合物为NaOH,其电子式为式 ,
,
故答案为: ;
;
(3)HF含氢键沸点较高,则⑥的气态氢化物与⑩的气态氢化物的沸点高低为HF>HCl,
故答案为:HF>HCl;
(4)④和⑤分别形成的10电子微粒分别为氨气、水,二者反应为NH3+H2O=NH3•H2O,故答案为:NH3+H2O=NH3•H2O;
(5)上述元素中,最高价氧化物对应水化物碱性最强的是NaOH;非金属性Cl>S,对应阴离子的还原性较强的为S2-,故答案为:NaOH;S2-.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语及规律性知识的使用,题目难度不大.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
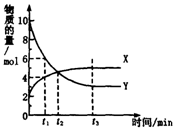 一定温度下在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为5Y?X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | 根据t2时的数据,可求出该温度下的平衡常数 | |
| D. | t3时,逆反应速率大于正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
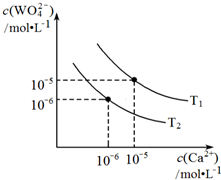 钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:
钨酸钙是非常重要的化学原料,主要用于生产钨铁、钨丝及钨合金等钨制品.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙.发生反应:| 温度/℃ | 25 | 50 | 90 | 100 |
| K1 | 79.96 | 208.06 | 222.88 | 258.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
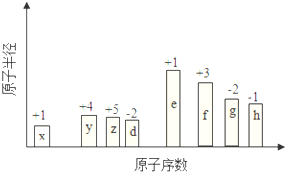 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.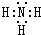 .位于第四周期且与z同主族的元素,其气态氢化物的化学式为AsH3.
.位于第四周期且与z同主族的元素,其气态氢化物的化学式为AsH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
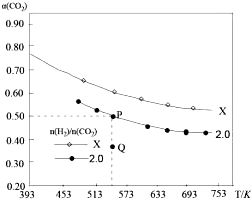 在两个固定容积均为1L密闭容器中以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比$\frac{n({H}_{2})}{n(C{O}_{2})}$充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | X的氢碳比X>2.0,且Q点在氢碳比为2.0时v(正)<v(逆) | |
| C. | 若起始时,CO2、H2浓度分别为0.5mol/L和1.0mol/L,则可得到P点,对应温度的平衡常数的值为512 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4、H2O,再次平衡后a(CO2)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 | |
| D. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物:CO2、NO、SO2、H2O | B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | ||
| C. | 铵盐:NH4Cl、NH4NO3、NH3•H2O | D. | 碱性氧化物:Na2O、CaO、CO2、Al2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com