
| A. | 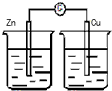 稀H2SO4 | B. | 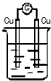 AgNO3 | C. | 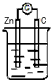 甘油 | D. | 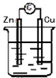 稀H2SO4 |
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | H2>N2>O2 | |
| B. | NH3>AsH3>PH3 | |
| C. | Cl2>Br2>I2 | |
| D. | C(CH3)4>(CH3)2CHCH2CH3>CH3CH2CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag2O作正极,被氧化 | |
| B. | 若将电解液换成酸性溶液,使用寿命会缩短 | |
| C. | Zn作正极,被还原 | |
| D. | OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(CO):通O2,点燃 | B. | CO(CO2):通过NaOH溶液 | ||
| C. | N2(O2):通过灼热的CuO | D. | CaO(CaCO3):加水,再过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
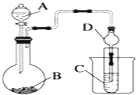 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因是同一反应,所以用不同物质表示化学反应速率时,所得数值是相同的 | |
| B. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| C. | 化学反应速率为“1 mol/(L•min)”表示的意思是:时间为1 min 时,某物质的浓度为1 mol/L | |
| D. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
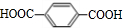 +2NaHCO3→
+2NaHCO3→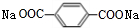 +2H2O+2CO2↑.
+2H2O+2CO2↑.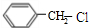 .
.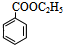 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$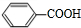 +CH3CH2OH.
+CH3CH2OH.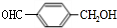 ,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n
,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n +n
+n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$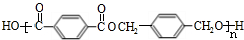 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 容器类型 | 起始物质的量/mol | 平衡时SO3的物质的量/mol | ||
| SO2 | O2 | SO3 | |||
| Ⅰ | 恒温恒容 | 2 | 1 | 0 | 1.2 |
| Ⅱ | 绝热恒容 | 0 | 0 | 2 | a |
| Ⅲ | 恒温恒压 | 2 | 1 | 0 | b |
| A. | 平衡时SO3的物质的量:a>1.2、b>1.2 | |
| B. | 容器Ⅱ、Ⅲ中平衡常数相同 | |
| C. | 容器 I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1 | |
| D. | 若起始时向容器Ⅰ中充入1.0mol SO2 (g)、0.40mol O2(g)和1.40mol SO3 (g),则此时ν正<ν逆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com