
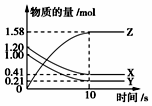
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.079mol•(L•s)-1 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol•L-1 | |
| C. | 该反应不是可逆反应 | |
| D. | 反应的化学方程式为X(g)+Y(g)?Z(g) |
分析 A、根据v=$\frac{△c}{△t}$计算化学反应速率;
B、根据平衡图象计算10s,X的物质的量浓度减少;
C、根据平衡图象可以看出,反应达平衡时x、Y、z都存在判断;
D、根据化学反应中各物质的物质的量变化量与化学计量数之比呈正比书写化学方程式.
解答 解:A.反应开始到10s,用Z表示的反应速率$\frac{\frac{1.58mol}{2L}}{10s}$=0.079mol/(L•s),故A正确;
B.反应开始到10s,X的物质的量浓度减少了$\frac{1.2mol-0.41mol}{2L}$=0.395mol/L,故B错误;
C.由平衡图象可以看出,反应达平衡时x、Y、z都存在,所以该反应是可逆反应,故C错误;
D.由图象可以看出,反应中x、Y的物质的量减少,应为反应物,z的物质的量增多,应为生成物,当反应进行到10s时,△n(X)=0.79mol,△n(Y)=0.79mol,△n(Z)=1.58mol,则△n(X):△n(Y):△n(Z)=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为X(g)+Y(g)?2Z(g),故D错误;
故选A.
点评 本题考查化学平衡图象问题,题目难度不大,解题时注意分析图象中各物理量的变化曲线,把握相关物理量的计算.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
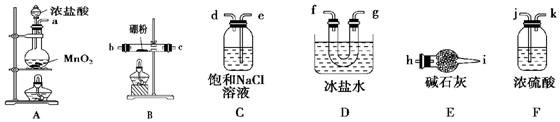
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蘸浓盐酸的玻璃棒靠近盛放氨气的装置,检查是否漏气 | |
| B. | 浓硫酸沾在皮肤上,立刻用稀氢氧化钠溶液冲洗 | |
| C. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| D. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15 mol | B. | 0.3 mol | C. | 0.45 mol | D. | 0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400mL | B. | 500mL | C. | 450mL | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
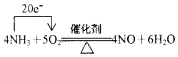 .若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为$\frac{22.4n}{5V}$(写出含字母的表达式).
.若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为$\frac{22.4n}{5V}$(写出含字母的表达式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热 | |
| C. | 燃烧热和中和热是反应热的种类之一 | |
| D. | 在稀溶液中,1 mol乙酸和1 mol氢氧化钠完全中和时放出的热量为57.3 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com