
| A. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| B. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 | |
| C. | 绿色化学反应选择的原料、催化剂、溶剂都应该是无毒无害的 | |
| D. | 乙烯分别与溴水和溴的四氯化碳溶液反应制备1,2-二溴乙烷的原子利用率均为100% |
分析 A、根据绿色化学的核心进行判断;
B、将反应物的原子全部转化为期望的最终产物,可以减少污染,使原料的利用率提高;
C、绿色化学选择的原料、催化剂、溶剂均应是安全、能降解、可再利用的环境友好产品;
D、乙烯含有碳碳不饱和键,能和溴发生加成反应.
解答 解:A、绿色化学的核心是要利用化学原理从源头上减少和消除工业生产对环境的污染,故A正确;
B、按照绿色化学原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,这时原子利用率为100%,原子利用率=期望产物的总质量/生成物的总质量,故B正确;
C、绿色化学选择的原料、催化剂、溶剂都应该是无毒无害的,产物应该是安全、能降解、可再利用的环境友好产品,故C正确;
D、乙烯与溴水(Br2、HBr、HBrO)的反应,除了生成1,2-二溴乙烷 (CH2=CH2+Br2→BrCH2CH2Br)的反应外,还有生成溴乙烷(CH2=CH2+HBr→CH3CH2Br)和2-溴乙醇(CH2=CH2+HO-Br→BrCH2CH2OH)的反应,反应的选择性不很高,原子利用率不可能100%,乙烯与溴的四氯化碳溶液反应只生成1,2-二溴乙烷,没有副产物,故D错误.
故选D.
点评 本题考查了绿色化学的思想,应注意的是绿色化学的思想是从源头上减少和消除工业生产对环境的污染.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题
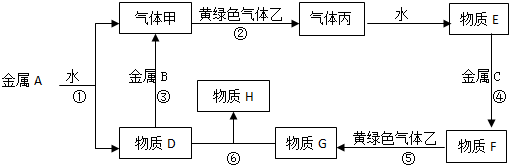
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
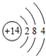 ;
;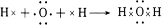 ;
;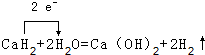 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
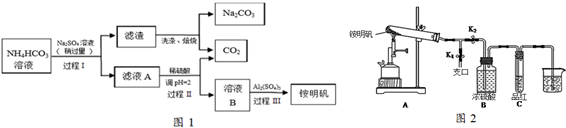
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
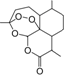 我国女科学家屠呦呦的名字出自《诗经•小雅》:“呦呦鹿鸣,食野之蒿.我有嘉宾,德音孔昭”,她因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖.下列有关青蒿素的叙述错误的是( )
我国女科学家屠呦呦的名字出自《诗经•小雅》:“呦呦鹿鸣,食野之蒿.我有嘉宾,德音孔昭”,她因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖.下列有关青蒿素的叙述错误的是( )| A. | 分子式为C15H20O5 | B. | 易溶于C2H5OC2H5 | ||
| C. | 官能团有醚键和酯基 | D. | 能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
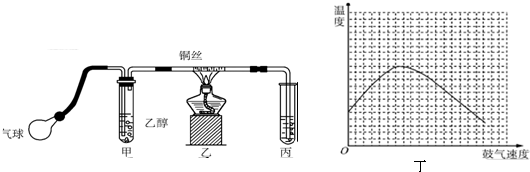
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
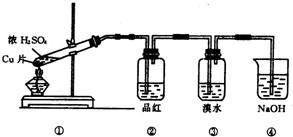
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 3,3,4,4-四甲基庚烷 | D. | 3,5-二甲基乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com