
【题目】对氮及其化合物的研究具有重要意义。
(1)对于2NO(g)+O2(g) ![]() 2NO2(g)反应包含以下两个基元反应:
2NO2(g)反应包含以下两个基元反应:
① 2NO(g) ![]() N2O2(g)(快) ΔH1<0 ,υ1正=k1正c2(NO)、υ1逆=k1逆c(N2O2);
N2O2(g)(快) ΔH1<0 ,υ1正=k1正c2(NO)、υ1逆=k1逆c(N2O2);
② N2O2(g)+O2(g) ![]() 2NO2(g)(慢) ΔH2<0,υ2正=k2正c(N2O2)c(O2)、υ2逆=k2逆c2(NO2);决定2NO(g)+O2(g)
2NO2(g)(慢) ΔH2<0,υ2正=k2正c(N2O2)c(O2)、υ2逆=k2逆c2(NO2);决定2NO(g)+O2(g) ![]() 2NO2(g)反应速率快慢的基元反应是________(填标号)。一定条件下,反应2NO(g)+O2(g)
2NO2(g)反应速率快慢的基元反应是________(填标号)。一定条件下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,平衡常数K=_______(用含有k1正、k1逆、k2正、k2逆 的代数式表示)
2NO2(g)达到平衡状态,平衡常数K=_______(用含有k1正、k1逆、k2正、k2逆 的代数式表示)
(2)使用SNCR脱硝技术的主反应为:
4NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2O(g) △H<0
4N2(g)+6H2O(g) △H<0
副反应:4NH3(g)+4O2 (g) ![]() 2N2O (g)+6H2O (g) △H<0
2N2O (g)+6H2O (g) △H<0
下表在密闭体系中进行实验,起始投入一定量NH3、NO、O2,测定不同温度下,在相同时间内各组分的浓度。

N2浓度变化趋势___________________,试解释原因______________________,
根据表中数据推测,副反应开始发生的温度区间是_____________________。

(3)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。请写出氮气在固氮酶作用下发生的化学反应_________。
【答案】② K=![]() 先上升后下降 先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动, N2浓度降低 550K—600K之间 N2+6H++6MV+=2NH3+6MV2+
先上升后下降 先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动, N2浓度降低 550K—600K之间 N2+6H++6MV+=2NH3+6MV2+
【解析】
(1)决定2NO(g)+O2(g) ![]() 2NO2(g)反应速率快慢决定于进行慢的反应,即反应②;一定条件下,反应2NO(g)+O2(g)
2NO2(g)反应速率快慢决定于进行慢的反应,即反应②;一定条件下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,即υ正=υ逆,两个基元反应也要遵循平衡时正逆反应速率相等,则υ1正=υ1逆,即k1正c2(NO) =k1逆c(N2O2),则
2NO2(g)达到平衡状态,即υ正=υ逆,两个基元反应也要遵循平衡时正逆反应速率相等,则υ1正=υ1逆,即k1正c2(NO) =k1逆c(N2O2),则![]() ,υ2正=υ2逆,即k2正c(N2O2)c(O2)=k2逆c2(NO2),则
,υ2正=υ2逆,即k2正c(N2O2)c(O2)=k2逆c2(NO2),则 ,因此该反应平衡常数K=
,因此该反应平衡常数K= =
= =
=![]() 。
。
(2)根据表格数据可知,反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动, N2浓度降低,N2浓度变化趋势为先上升,后下降;根据数据,550K时N2浓度达到最大,且550K之前转化的NH3与生成的N2物质的量相等,之后继续升温,N2浓度开始减小,温度过高导致氨气与氧气发生副反应,产生一氧化二氮,副反应开始发生的温度区间是550K—600K之间;
(3)根据示意图所示,氢气在氢化酶的作用下与MV2+反应生成H+和MV+,氮气在固氮酶的作用下与MV+、氢离子反应生成氨气和MV2+,可得到反应方程式。
(1)决定2NO(g)+O2(g) ![]() 2NO2(g)反应速率快慢决定于进行慢的反应,即反应②;一定条件下,反应2NO(g)+O2(g)
2NO2(g)反应速率快慢决定于进行慢的反应,即反应②;一定条件下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,即υ正=υ逆,则υ1正=υ1逆,即k1正c2(NO) =k1逆c(N2O2),则
2NO2(g)达到平衡状态,即υ正=υ逆,则υ1正=υ1逆,即k1正c2(NO) =k1逆c(N2O2),则![]() ,υ2正=υ2逆,即k2正c(N2O2)c(O2)=k2逆c2(NO2),则
,υ2正=υ2逆,即k2正c(N2O2)c(O2)=k2逆c2(NO2),则 ,因此该反应平衡常数K=
,因此该反应平衡常数K= =
= =
=![]() ,
,
答案为:②;![]() ;
;
(2)根据表格数据可知,反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动, N2浓度降低,N2浓度变化趋势为先上升,后下降;根据数据,550K时N2浓度达到最大,且550K之前转化的NH3与生成的N2物质的量相等,之后继续升温,N2浓度开始减小,温度过高导致氨气与氧气发生副反应,产生一氧化二氮,副反应开始发生的温度区间是550K—600K之间;
答案为:先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动, N2浓度降低;550K—600K之间;
(3) 根据示意图所示,氢气在氢化酶的作用下与MV2+反应生成H+和MV+,氮气在固氮酶的作用下与MV+、氢离子反应生成氨气和MV2+,则氮气在固氮酶作用下发生的化学反应为N2+6H++6MV+=2NH3+6MV2+,
答案为:N2+6H++6MV+=2NH3+6MV2+。


科目:高中化学 来源: 题型:
【题目】某学生用0.1000mol·L-1标准NaOH溶液滴定未知浓度的盐酸,其操作为以下几步:
A.用标准NaOH溶液润洗碱式滴定管2~3次
B.取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
C.把盛有标准NaOH溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液
D.调节液面至“0”或“0”刻度以下,记下读数
E.移取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定到终点,并记下滴定管液面的读数
(1)下图中属于碱式滴定管的_____(选填:“甲”、“乙”)。

(2)判断到达滴定终点的实验现象是_____。
(3)上述E步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是_____(填“偏大”或“偏小”或“无影响”)。
(4)若平行实验三次,记录的数据如下表
滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
滴定前读数(/mL) | 滴定后读数(/mL) | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
试计算待测盐酸的物质的量浓度(写出计算过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
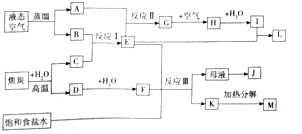
【题目】如图是某大型化工生产的工艺流程图![]() 部分反应物或生成物已经略去
部分反应物或生成物已经略去![]() :
:
请回答下列问题:
![]() 流程中所涉及的化学工业有:合成氨、 ______ 联合制碱法
流程中所涉及的化学工业有:合成氨、 ______ 联合制碱法![]() 或侯式制碱法
或侯式制碱法![]() .
.
![]() 工业从液态空气中分离出A、B利用的原理是 ______ .
工业从液态空气中分离出A、B利用的原理是 ______ .
![]() 图示中G生成H的流程中为了提高原料的利用率和减少污染,生产中往往采取的操作是 ______ .
图示中G生成H的流程中为了提高原料的利用率和减少污染,生产中往往采取的操作是 ______ .
![]() 工业生产反应Ⅰ的方程式为 ______ ,为提高原料转化率的反应条件是 ______ ,生产中需将产物液化分离的目的是 ______ .
工业生产反应Ⅰ的方程式为 ______ ,为提高原料转化率的反应条件是 ______ ,生产中需将产物液化分离的目的是 ______ .
![]() 写出反应Ⅱ的化学方程式 ______ .
写出反应Ⅱ的化学方程式 ______ .
![]() 图示中生成小苏打的化学方程式 ______ ,母液与K分离的方法是 ______
图示中生成小苏打的化学方程式 ______ ,母液与K分离的方法是 ______ ![]() 有两种方案从母液中获得副产品J:
有两种方案从母液中获得副产品J:![]() 通入氨气、冷却、加食盐、过滤
通入氨气、冷却、加食盐、过滤![]() 不通氨气、冷却、加食盐、过滤对比这两种方案.方案
不通氨气、冷却、加食盐、过滤对比这两种方案.方案![]() 通入氨气的作用 ______ ;方案
通入氨气的作用 ______ ;方案![]() 滤液一般不能反复循环利用,其原因是 ______ .
滤液一般不能反复循环利用,其原因是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如下实验装置,请你参与探究,并回答问题:
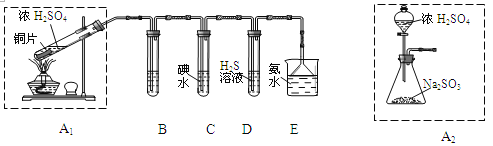
①装置A1中发生反应的化学方程式为 ;
②装置B用于检验SO2的漂白性,其中所盛试剂为 ,装置D用于检验SO2的 性质;
③装置C中反应的离子方程式为 ;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写二点) 、 ;
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)。
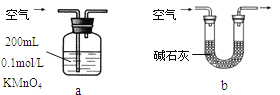
①你认为哪个装置可行(填序号) ,使用你所选用的装置测定SO2含量时,还需要测定的物理量是 ;
②你认为哪个装置不可行(填序号) ,说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素 X、Y、Z、W 的相对位置如表,元素 X 的原子核外电子数是 Z的 2 倍。下列说法不正确的是

A. W 元素的简单气态氢化物的热稳定性比 Z 元素的简 单气态氢化物的高
B. 气体分子(ZW)2 的结构式为 N≡C—C≡N
C. X、Y、W 三种元素的简单离子半径最大的是 Y
D. 元素 X 位于周期表中第三周期、第ⅡA族,其单质制备可用电解熔融 XCl2 的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入2molA和1molB发生反应:2A(g)+B(g)![]() xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%。则x的值为( )
xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%。则x的值为( )
A.只能为2B.只能为3C.只能为4D.可能为2或3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)NH3的电子式______。
(2)氯化铵水溶液显酸性,其原因为______(用离子方程式表示),0.1mol/L的氨水中加入少量的NH4Cl固体,溶液的pH______(填“升高”或“降低”);若加入少量的明矾固体后,请尝试从平衡移动的角度解释溶液中NH4+浓度的变化原因______。
(3)硝酸铵加热分解可得到N2O(g)和H2O(g),250℃时,硝酸铵在密闭容器中分解达到平衡,该温度下反应的平衡常数表达式为______;若有1mol硝酸铵完全分解,转移的电子数为______mol。
(4)3H2(g)+N2(g)2NH3(g)△H=-92kJ/mol,若反应放出9.2kJ 热量,则参加反应的氢气分子数目为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为![]() 的密闭容器内,物质D在
的密闭容器内,物质D在![]() 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
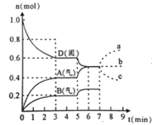
A.从反应开始到第一次达到平衡时,B物质的平均反应速率为![]()
B.该反应的化学方程式为![]() ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为![]()
C.已知:反应的![]() ,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D.若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是b曲线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com