
| 分类标准 | 酸性氧化物 | 能导电 | 电解质 |
| 属于该类的物质 | ③④ | ②⑦⑧⑨ | ⑤⑥⑨ |
分析 (1)酸性氧化物是指:氧化物和碱发生反应生成盐和水的氧化物,发生的反应是复分解反应;
物质能够导电,主要存在自由移动的导电粒子即可;
在水溶液和熔融状态下都不导电的化合物为非电解质,在水溶液或熔融状态下能够导电的化合物电解质,据此进行判断;
(2)离子方程式H++OH-═H2O表示可溶性的强酸与可溶性的强碱发生中和反应,生成可溶性的盐,据此写出满足该条件下的化学反应方程式;
(3)少量的④CO2通入⑥Ba(OH)2的溶液中反应,是酸性氧化物和碱的反应生成盐和水,少量二氧化碳和氢氧化钡溶液反应生成碳酸钡沉淀和水;
(4)反应中元素化合价升高的物质失电子做还原剂被氧化,发生氧化反应,元素化合价降低的物质得到电子做氧化剂,被还原发生还原反应.
解答 解:(1)酸性氧化物是指和碱反应生成盐和水的氧化物,③SiO2 和碱反应的化学方程式为:SiO2+2NaOH=Na2SiO3+H2O,④CO2 和碱反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O,符合酸性氧化物概念,故选③④;
能够导电,物质中存在自由移动的导电粒子,满足该条件的有:②铝是金属存在自由移动的电子,能导电,⑦氨水是氨气的水溶液,存在自由移动的阴阳离子能导电,⑧稀硝酸是硝酸的水溶液属于强电解质溶液,存在自由移动的阴阳离子能导电,⑨熔融Al2(SO4)3 完全电离存在自由移动的阴阳离子能导电,故选②⑦⑧⑨;
电解质为在水溶液或熔融状态下能够导电的化合物,满足该条件的有:⑤H2SO4 是酸是化合物,水溶液中完全电离出离子,溶液能导电,属于电解质,⑥Ba(OH)2固体是盐属于化合物,溶于水完全电离出离子,能导电属于电解质,⑨熔融Al2(SO4)3是化合物,熔融状态完全电离,存在自由移动的阴阳离子能导电,属于电解质,故选⑤⑥⑨,
故答案为:
| 分类标准 | 酸性氧化物 | 能导电 | 电解质 |
| 属于该类的物质 | ③④ | ②⑦⑧⑨ | ⑤⑥⑨ |
点评 本题考查了物质的导电性、电解质、酸性氧化物的判断,氧化还原反应概念的分析,题目难度中等,注意明确电解质与非电解质的概念、物质导电性的条件,掌握离子方程式的意义及书写方法.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
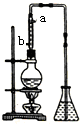 分液.
分液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| N-N | N═N | N≡N | N-H | H-H |
| 193 KJ/mol | 418KJ/mol | 946KJ/mol | 391KJ/mol | 436KJ/mol |
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
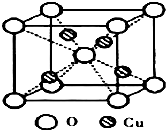 铜是过渡元素.化合物中,铜常呈现+1价或+2价.
铜是过渡元素.化合物中,铜常呈现+1价或+2价. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
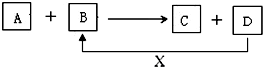 A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白:
A、B、C、D、X均为中学化学常见的物质.它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.44S | B. | 1S | C. | 1.33S | D. | 2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠溶液 | B. | AgN03溶液 | C. | 碳酸钠溶液 | D. | 紫色石蕊试液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com