
| A、Kw | B、K | C、Ka | D、Kb |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在安全可靠的前提下,提高核电在电力生产中的份额 |
| B、积极开发利用氢能源、太阳能、地热能和潮汐能等新能源 |
| C、鼓励家庭购买轿车,适当限制公共交通的发展 |
| D、积极开展绿化国土的行动,建立绿色家园 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该温度高于25℃ |
| B、由水电离出来的H+的浓度为1×10-10 mol/L |
| C、NaHSO4晶体的加入抑制了水的电离 |
| D、取该溶液加水稀释100倍,溶液中的c(OH-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四氧化三铁固体溶解在稀硝酸溶液中:Fe3O4+8H+═2Fe3++Fe2++4H2O |
| B、少量小苏打溶液滴人Ba(OH)2溶液中:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、硫氢化钠发生水解:HS-+H2O?H3O++S2- |
| D、用少量氨水吸收SO2气体:SO2+2NH3?H2O═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、给金属衣架或电线外面包上一层塑料层 |
| B、给自行车钢圈镀上一层金属铬 |
| C、在铁船身上镶嵌金属铜 |
| D、给铁栅栏表面涂上一层油漆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
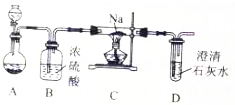
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com