
| A. | Fe、Si--主族元素 | B. | Na2O2--碱性氧化物 | ||
| C. | 阿司匹林--抗酸药 | D. | 醋--调味剂和防腐剂 |
分析 A、主族元素是短周期和长周期共同组成的族为主族;
B、和酸反应生成盐和水的氧化物为碱性氧化物,反应不是氧化还原反应;
C、阿司匹林是乙酰水杨酸,溶液显酸性;
D、醋成分为醋酸是调味品和防腐剂;
解答 解:A、主族元素是短周期和长周期共同组成的族为主族,Fe是ⅤⅢ族、Si是主族元素,故A错误;
B、和酸反应生成盐和水的氧化物为碱性氧化物,反应不是氧化还原反应,过氧化钠和水反应发生氧化还原反应,故B错误;
C、阿司匹林是乙酰水杨酸,溶液显酸性,不是抗酸药,故C错误;
D、醋成分为醋酸,属于酸是较好的调味品和防腐剂,故D正确;
故选D.
点评 本题考查了酸碱盐氧化物分类,物质性质的分析判断,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z |
| A. | X和Y都是非金属元素,其中X最高化合价为+5 | |
| B. | X、W的最高价氧化物在一定条件下能反应 | |
| C. | 元素X、W和氧元素可形成化学式为W2XO3,离子化合物 | |
| D. | Y、Z的氢化物的稳定性Y<2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2 | B. | FeCl3 | C. | O2 | D. | FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
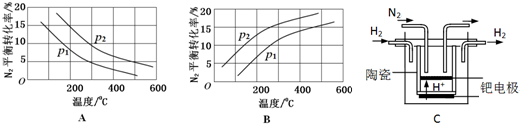
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
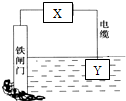
| A. | 若X为导线,Y可以是锌 | |
| B. | 若X为导线,铁闸门上的电极反应式为Fe-2e→Fe2+ | |
| C. | 若X为直流电源,铁闸门做负极 | |
| D. | 若X为直流电源,Y极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y2-的离子半径大于W3+的离子半径 | |
| B. | Y、Z形成的化合物为离子化合物 | |
| C. | Z的最高价氧化物对应的水化物的酸性比X的强 | |
| D. | X的气态简单氢化物的稳定性比Y的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com