
分析 (1)反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)根据n=$\frac{m}{M}$计算3.2gCu的物质的量,再根据方程式计算二氧化硫的物质的量,根据V=nVm计算二氧化硫的体积;
(3)根据方程式计算消耗硫酸物质的量,根据稀释后溶液中氢离子浓度计算剩余硫酸物质的量,进而计算原浓硫酸的物质的量浓度.
解答 解:(1)反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
答:反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)3.2gCu的物质的量=$\frac{3.2g}{64g/mol}$=0.05mol,
由方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知,n(SO2)=n(Cu)=0.05mol,故生成SO2的体积=0.05mol×22.4L/mol=1.12L,
答:反应中最多可以收集到标准状况下的气体为1.12L;
(3)由方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,可知反应消耗的H2SO4的物质的量=2n(Cu)=2×0.05mol=0.1mol,剩余的硫酸物质的量=$\frac{1}{2}$n(H+)=$\frac{1}{2}$×5.2mol/L×0.1L=0.26mol,原浓硫酸的物质的量为0.26mol+0.1mol=0.36mol,则原浓硫酸的物质的量浓度为$\frac{0.36mol}{0.02L}$=18mol/L,
答:原浓硫酸的物质的量浓度是18mol/L.
点评 本题考查化学方程式的有关计算,题目难度不大,明确发生的反应即可解答,注意Cu与稀硫酸不反应.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
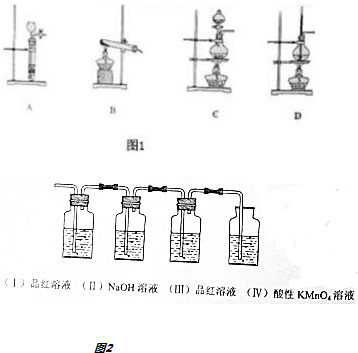
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则一定有NH4+ | |
| B. | 加入氯化钡有白色沉淀产生,再加盐酸,沉淀不消失,该溶液一定有SO42- | |
| C. | 加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,则原溶液中一定有CO32- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
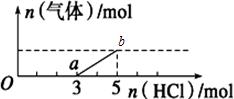
| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 标准状况下,通入CO2的体积为4.48L | |
| C. | ab段反应的离子方程式为:HCO${\;}_{3}^{-}$+H+=CO2↑+H2O | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | c(AlO2-)=0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
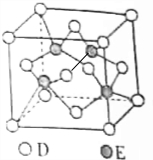 原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.
原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 牺牲阳极的阴极保护法利用的是原电池原理 | |
| B. | Fe2+能与[Fe(CN)6]3-反应生成带有特征蓝色的沉淀 | |
| C. | 电解质溶液的导电过程一定是电解质溶液的电解过程 | |
| D. | 如果在1.0L Na2CO3溶液中溶解0.010mol的BaSO4,则Na2CO3溶液的最初浓度不得低于0.24 mol/L[已知Ksp(BaSO4)=1.1×10-10; Ksp(BaCO3)=2.6×10-9] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含4molHCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2 | |
| B. | 标准状况下,22.4L己烷中共价键数为19NA | |
| C. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3 NA | |
| D. | 氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com