C
分析:A、酸式盐和碱反应量少的全部反应;
B、选项中的电子不守恒;
C、氢氧化钠吸收少量二氧化碳生成碳酸钠和水;
D、选项中电荷不守恒;
解答:A、NH
4HCO
3溶液与过量NaOH溶液反应,碳酸氢铵全部反应,离子方程式为;NH
4++2OH
-+HCO
3-=NH
3?H
2O+CO
32-+H
2O;故A错误;
B、金属铝溶于氢氧化钠溶液反应的离子方程式为:2Al+2H
2O+2OH
-=2AlO
2-+3H
2↑,故B错误;
C、用氢氧化钠溶液吸收少量二氧化碳反应的离子方程式为:2OH
-+CO
2=
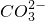
+H
2O,故C正确;
D、Fe
2(SO
4)
3的酸性溶液中通入足量硫化氢发生氧化还原反应,离子方程式为:2Fe
3++H
2S=2Fe
2++S↓+2H
+;故D错误;
故选C.
点评:本题考查了离子方程式的正误判断和注意问题,主要考查酸式盐和碱的反应,量不同产物不同的分析判断,氧化还原反应的产物判断.

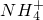 +OH-=NH3↑+H2O
+OH-=NH3↑+H2O +H2↑
+H2↑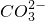 +H2O
+H2O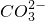 +H2O,故C正确;
+H2O,故C正确;
