
| A. | 及时分离出NO2气体 | B. | 适当升高温度 | ||
| C. | 增大O2的浓度 | D. | 选择高效催化剂. |
科目:高中化学 来源: 题型:选择题
| A. | M | B. | M2+ | C. | M3+ | D. | MO2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
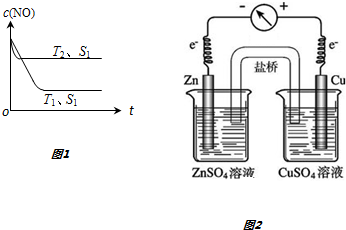
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
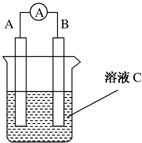 如图所示是原电池的装置图(
如图所示是原电池的装置图( 为电流表).请回答:
为电流表).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 淀粉溶液、乙醇、苯、四氯化碳 | B. | 乙烯、乙烷、乙炔、丙烯 | ||
| C. | 甲酸、乙醛、乙醇、乙酸 | D. | 苯酚、溴苯、苯、甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
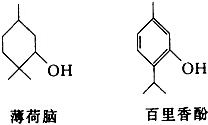 下列物质是几种常见香精的主要成分:
下列物质是几种常见香精的主要成分: .
.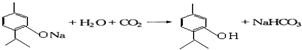 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
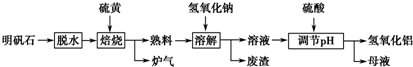
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 | 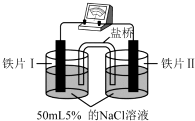 | 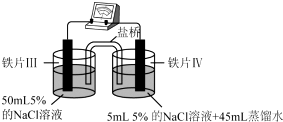 |
| 现象 | 电流计指针未发生偏转 | 电流计指针偏转 |
| A. | “电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 | |
| B. | 用K3[Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极 | |
| C. | 铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,二者的腐蚀速率相等 | |
| D. | 铁片Ⅳ的电极反应式为Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某试样焰色反应呈黄色,则试样中含有K+ | |
| B. | 广泛pH试纸测得某碱性溶液的pH为12.5 | |
| C. | 容量瓶不能用作溶解物质的容器 | |
| D. | 粗盐的提纯试验中,滤液在坩埚中加热蒸发结晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com