
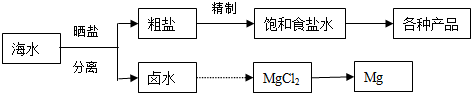
| A. | 可用电解饱和MgCl2溶液的方法获得金属镁 | |
| B. | 电解法精炼粗铜,用粗铜作阳极,纯铜作阴极 | |
| C. | 电解熔融Al2O3制备金属铝时,加入冰晶石使Al2O3更易熔化 | |
| D. | 氯碱工业中电解食盐水时,阳离子交换膜可防止氯气与NaOH溶液反应 |
分析 A.电解氯化镁溶液生成氢气、氯气和氢氧化镁;
B.电解法精炼粗铜时,粗铜作阳极,纯铜作阴极;
C.电解熔融Al2O3制备金属铝时,要加入冰晶石,降低氧化铝的熔点,使Al2O3在较低温度下熔解;
D.电解时,阳离子经过离子交换膜向阴极区移动;
解答 解:A.电解氯化镁溶液生成氢气、氯气和氢氧化镁,工业上冶炼金属镁的方法是电解熔融状态的氯化镁,错误;
B.电解法精炼粗铜时,粗铜作阳极,纯铜作阴极,故B正确;
C.电解熔融Al2O3制备金属铝时,加入冰晶石是为了降低三氧化二铝的熔点,使Al2O3更易熔化,故C正确;
D、电解时,阳离子经过离子交换膜向阴极区移动,所以阳离子交换膜的作用是阻止OH-移向阳极,以使氢氧化钠在阴极区富集,故D正确;
故选:A.
点评 本题考查了金属的冶炼、氯碱溶液工业,熟悉金属活泼性、电解池工作原理是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氢氧化钠固体 | B. | 加水 | ||
| C. | 通入二氧化碳气体 | D. | 加入饱和石灰水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
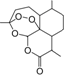 我国女科学家屠呦呦的名字出自《诗经•小雅》:“呦呦鹿鸣,食野之蒿.我有嘉宾,德音孔昭”,她因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖.下列有关青蒿素的叙述错误的是( )
我国女科学家屠呦呦的名字出自《诗经•小雅》:“呦呦鹿鸣,食野之蒿.我有嘉宾,德音孔昭”,她因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖.下列有关青蒿素的叙述错误的是( )| A. | 分子式为C15H20O5 | B. | 易溶于C2H5OC2H5 | ||
| C. | 官能团有醚键和酯基 | D. | 能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
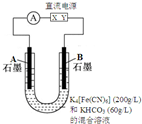 气态废弃物中的硫化氢可用下法转化为可利用的硫.
气态废弃物中的硫化氢可用下法转化为可利用的硫.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
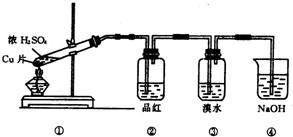
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
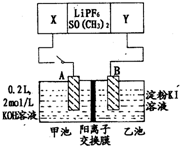 已知高能锂电池的总反应式为:2Li+FeS═Fe+Li2S[LiPF6.SO( CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H2 4.48L.下列有关叙述不正确的是( )
已知高能锂电池的总反应式为:2Li+FeS═Fe+Li2S[LiPF6.SO( CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H2 4.48L.下列有关叙述不正确的是( )| A. | 从隔膜中通过的离子数目为0.4 NA | |
| B. | 若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为4 mol/L | |
| C. | A电极为阳极 | |
| D. | 电源正极反应式为:FeS+2Li++2e-═Fe+Li2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进入煤矿矿井时用火把照明 | |
| B. | 实验室在通风橱中制备氯气 | |
| C. | 将水倒入浓硫酸配制稀硫酸 | |
| D. | 用点燃的火柴在液化气钢瓶口检验是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
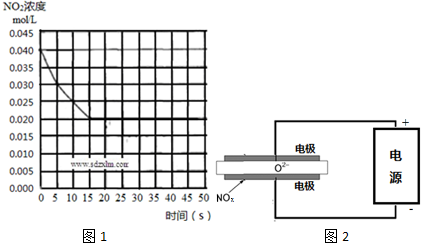
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com