
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.分析 ①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,根据浓度变化量之比等于化学计量数之比氢气的浓度变化量,根据v=$\frac{△c}{△t}$计算v(H2);
②使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量;
③已知a.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1277kJ•mol-1
b.2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
c.C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
d.H2O(g)=H2O(l)△H=-44kJ•mol-1
根据盖斯定律:$\frac{1}{2}$a-$\frac{1}{2}$b+2d得到:CH3OH(l)+O2(g)=CO(g)+2H2O(l),据此计算.
解答 解:(1)由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L•mon),
故答案为:0.225mol/(L•min);
(2)使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量,
A、该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误,
B、充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误,
C、将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确,
D、再充入1mol CO2和3mol H2,相当于增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
故答案为:CD;
③已知a.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1277kJ•mol-1
b.2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
c.C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ•mol-1
d.H2O(g)=H2O(l)△H=-44kJ•mol-1
根据盖斯定律:$\frac{1}{2}$a-$\frac{1}{2}$b+2d得到:CH3OH(l)+O2(g)=CO(g)+2H2O(l),△H=$\frac{1}{2}$×(-1277kJ•mol-1)-$\frac{1}{2}$×(-566kJ•mol-1)+(-44kJ•mol-1)=-443.5 kJ•mol-1;
故答案为:-443.5 kJ•mol-1.
点评 本题考查反应速率计算、化学平衡移动的影响因素、盖斯定律的应用等,题目难度中等,注意基础知识的掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 对废旧电池进行回收处理 | |
| B. | 禁止生产、销售、使用超薄塑料购物袋 | |
| C. | 对聚乙烯等塑料垃圾进行深埋或倾倒入海 | |
| D. | 使用沼气、太阳能、风能等能源替代传统的煤炭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

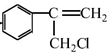 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙 +HCl$\stackrel{一定条件}{→}$
+HCl$\stackrel{一定条件}{→}$ (不需要注明反应条件)
(不需要注明反应条件)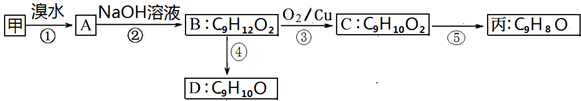
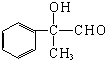 ;丙的结构简式为
;丙的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 短周期中次外层电子数是最外层电子数2倍的元素一定是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、SO${\;}_{4}^{2-}$、Al3+ | B. | Fe2+、NO${\;}_{3}^{-}$、Na+、Cl- | ||
| C. | S2-、Na+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$ | D. | SO${\;}_{3}^{2-}$、K+、NO${\;}_{3}^{-}$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 甲烷在空气中燃烧 | D. | 加热条件下H2与CuO反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | |
| W |
 (1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为
(1)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为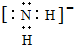 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 氮的固定只有在高温、高压、催化剂的条件下才能实现 | |
| C. | 服用铬含量超标的药用胶囊会对人体健康不会造成危害 | |
| D. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com